染色样本分析
操作步骤
1.准备蛋白质储备溶液(溶液A):
将100μL反应缓冲液(如1 M碳酸钠溶液或1 Mlin酸盐缓冲液,pH~9.0)与900μL目标蛋白溶液(如抗体,蛋白质浓度> 2 mg / ml,如果可能)混合至100μL,再加入1 mL蛋白质标记原液。
注1:蛋白质溶液(溶液A)的pH值应为8.5±0.5。如果蛋白质溶液的pH低于8.0,则使用1M碳酸氢钠溶液或1M pH 9.0lin酸盐缓冲液将pH调节至8.0-9.0的范围。
注2:蛋白质应溶解于pH7.2-7.4的1Xlin酸盐缓冲盐水(PBS)中。如果蛋白质溶解在Tris或甘氨酸缓冲液中,则必须用pH7.2-7.4的1X PBS透析,以除去guang泛用于蛋白质沉淀的游离胺或铵盐(例如硫酸铵和乙酸铵)。
注3:不纯的抗体、稳定的牛血清蛋白(BSA)抗体或明胶不会被很好的标记。die氮化钠或硫柳汞的存在也可能干扰缀合反应。可以通过透析或旋转柱除去die氮化钠或硫柳汞,以获得标记结果。
注4:如果蛋白质浓度低于2 mg / mL,则结合效率会显着降低。为获得标记效率,建议zuiu终蛋白质浓度范围为2-10 mg / mL。
2.准备染料储备溶液(溶液B):
将无水DMSO加入到iFluor 染料SE小瓶中以制备10-20mM储备溶液。 通过移液或涡旋混合均匀。
注意:在开始缀合前准备染料储备溶液(溶液B),及时使用。 染料储备溶液的长期储存可降低染料活性。 溶液B可在冰箱中保存两周,避光保存。 避免冻融循环。
3.确定染料/蛋白质比例(可选):
注意:每种蛋白质都需要不同的染料/蛋白质比例,这也取决于染料的性质。蛋白质的过度标记可能影响其结合亲和力,而低染料/蛋白质比率的蛋白质缀合物会降低灵敏度。我们建议您通过使用连续不同量的标记染料溶液重复步骤4和5来实验确定染料/蛋白质比率。通常,对于大多数染料 - 蛋白质缀合物,推荐使用4-6种染料/蛋白质。
3.1使用10:1摩尔比的溶液B(染料)/溶液A(蛋白质)作为起始点:将5μl染料储备溶液(溶液B,假设染料储备溶液为10 mM)加入到样品瓶中。蛋白质溶液(95μl溶液A)you效摇动。假设蛋白质浓度为10mg / mL并且蛋白质的分子量为~200KD,蛋白质的浓度为~0.05mM。
注意:蛋白质溶液中DMSO的浓度应<10%。
3.2运行缀合反应(参见下面的步骤4)。
3.3重复#3.2,溶液B /溶液A的摩尔比为5:1;分别为15:1和20:1。
3.4使用预制的旋转柱纯化所需的缀合物。
3.5计算上述4种结合物的染料/蛋白质比(DOS)。
3.6检测上述4种结合物,确定的染料/蛋白质比例,以扩大标记反应。
4.运行结合反应:
4.1you效加入适量的染料储备溶液(溶液B)到蛋白质溶液(溶液A)的小瓶中晃动。
注意:溶液B /溶液的摩尔比由步骤3.6确定。如果跳过步骤3,我们建议使用10:1溶液B(染料)/溶液A(蛋白质)的摩尔比。
4.2继续在室温下旋转或摇动反应混合物30-60分钟。
5.纯化缀合物
以下方案是使用Sephadex G-25柱纯化染料 - 蛋白质缀合物的实例。
5.1按照说明书准备Sephadex G-25色谱柱。
5.2将反应混合物(直接从步骤4)加载到Sephadex G-25柱的顶部。
5.3样品在顶部树脂表面下方运行时立即加入PBS(pH 7.2-7.4)。
5.4向所需样品中加入更多PBS(pH 7.2-7.4)以完成色谱柱纯化。
注1:立即使用时,染料 - 蛋白质偶联物需要用染色缓冲液稀释,并等分多次使用。
注2:对于长期储存,染料 - 蛋白质缀合物溶液需要浓缩或冷冻干燥。
图示
 图1.将HeLa细胞与(Tubulin +)或(Tubulin-)小鼠抗微管蛋白一起孵育,然后与iFluor 488山羊抗小鼠IgG缀合物(绿色,左)和AlexaFluor?488山羊抗小鼠IgG缀合物(绿色)一起孵育,右)。细胞核用Hoechst 33342(蓝色)染色。 | 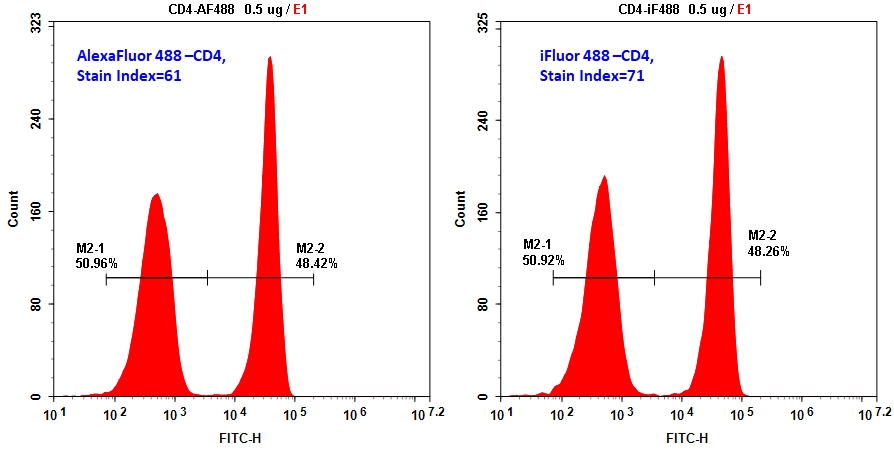 图2.人淋巴细胞上AlexaFluor?488和iFluor 488抗人CD4的流式细胞仪分析。在每个测试中,PBMC细胞都用0.5 ug 488抗人CD4和0.5 ug iFluor 488抗人CD4染色。在ACEA流式细胞仪系统上进行流式细胞仪分析。 | 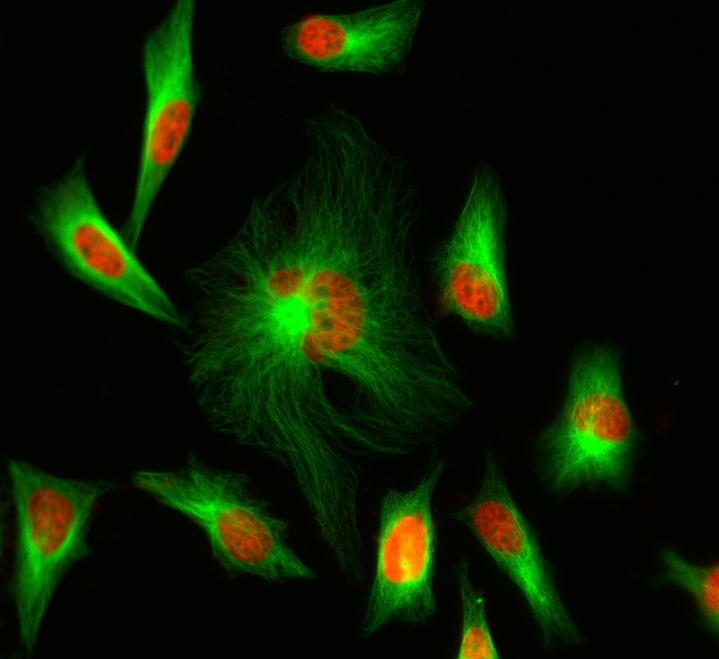 图3. HeLa细胞先用兔抗微管蛋白染色,再用iFluor 488山羊抗兔IgG(H + L)染色,细胞核用nuclear red DCS1染色。 |