概述
随着大家实验对类器官模型的需求越来越多,类器官培养已经成为我们必备的一项实验技能。然而,类器官培养相对细胞复杂,诸多的细节需要注意,需要一个详细的流程来指导我们快速掌握类器官培养技术。不同种类的类器官培养步骤大同小异,因此我们掌握了通用方法,在不同类器官上适当调整操作步骤即可,今天小爱为大家奉上史上最详类器官培养攻略,不看遗憾一万年呐!!!
流程
类器官有多种培养方法,比如使用超低吸附培养板和生物反应器,基质胶法等,今天咱来讲一讲基质胶法。
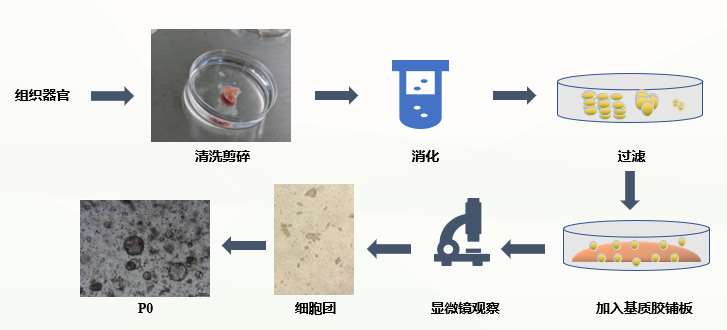
类器官原代培养流程
原代(以人肠癌类器官为例)
一、准备工作
1、仪器设备
CO2 培养箱、双人单面超净台、倒置显微镜、台式冷冻离心机、水浴锅(abs72023)或水浴摇床,医用冰箱、-80℃冰箱、移液器(一套)、眼科剪、眼科镊。
2、试剂耗材(以肠癌为例)
人肠癌类器官培养基试剂盒(abs9445),基质胶(低因子、无酚红)(abs9495),60mm细胞培养皿(abs7005), 100μm滤筛(abs7009),15mL离心管(abs7102),1.5mL EP管若干(abs7119),24孔细胞培养板(abs7058)、金属冰盒、眼科剪刀、眼科镊。
组分名称 | 规格 |
人肠癌类器官培养基A | 100mL |
类器官原代培养缓冲液B | 250mL |
人肠癌原代组织消化液C | 30mL |
类器官传代消化液D | 30mL |
组织保存液E | 100mL |
类器官冻存液F | 20mL |
类器官传代培养缓冲液G | 250mL |
二、操作流程
1、样本准备
(1)将组织放入含有预冷的(2-8°C)组织保存液E的取样瓶中(浸没整个组织),4℃从医院/实验室取回。
(2)将取样瓶消毒,组织取出放入培养皿样本拍照,并登记,大小,颜色,软硬程度,组织类型等信息。

2、清洗-剪碎
(1)在60mm细胞培养皿(abs7005)里用2-3mL原代培养缓冲液B浸泡。用原代培养缓冲液B清洗三次(每次更换培养皿)后剪碎,剪成大约1-3mm3的组织块,转移至15mL离心管。
3、消化-过滤
(2)向15mL离心管中加入5倍人肠癌原代组织消化液 C(消化液体积:组织体积=5:1,如果估量组织体积困难,使用5mL消化液通常足够)在37℃进行消化15-30min(消化过程中随时观察消化情况)。
(3)取少量液体在显微镜下观察,镜下观察到较多的细胞团(5-50个细胞抱团)后, 加入3倍体积原代培养缓冲液B (缓冲液体积:消化液体积=3:1)终止消化,用枪头轻柔吹打可以看到液体变浑浊。

(4)使用100μm滤筛(abs7009)进行过滤,取少量滤液在镜下进行观察。将滤液收集到15mL离心管,于300g 4℃富集离心5min后移去上清。

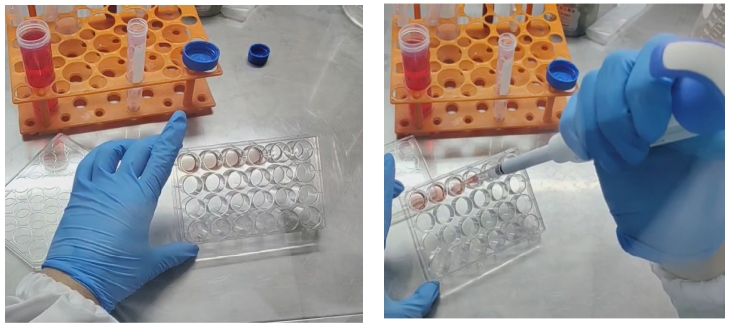
4、加胶-点板-加液(这里是整个原代操作的点睛之笔)
(1)准备工作
a 基质胶需用金属冰盒盛放在4℃冰箱过夜融化
b 枪头、离心管需要-20℃提前预冷至少半小时
c 融化后的基质胶可一直放4℃储存,建议2周内用完

低温金属冰盒(abs7289)
(2)接种要求
24孔板(abs7035),每孔25uL基质胶细胞团混合物,500-750uL类器官培养液
(3)接种密度
密度建议1:基质胶体积:细胞团沉淀体积=25:1(如果估摸细胞团沉淀体积困难,通常加300uL基质胶足够)
密度建议2:500个细胞团/25uL基质胶(如果想计数接种,可以参照此密度建议)
(4)加胶-点板
向细胞团沉淀加入基质胶(abs9495),进行吹打混匀(不要满吹满打,容易产生气泡),然后进行点板。整个操作在金属冰盒或冰上进行。操作熟练以后,加胶,混匀,点板控制在半分钟内,有利于保持基质胶良好的流畅性。
(5)加液
将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μL人肠癌类器官培养基A进行培养。大概10-14天,多数类器官直径在200um-500um,可进行传代操作。

人结肠癌-10x铺板密度
传代(消化分两种情况)
一、类器官数量较多或体积较大传代步骤
1、类器官收集及洗涤
1)收集:移液器吸去培养基,每孔添加1-2mL左右4℃类器官传代培养缓冲液G,轻柔吹散基质胶,收集在15mL离心管中(24孔板,每5孔为一组)。

2)洗涤:加类器官传代培养缓冲液G定容至14mL(缓冲液越多,基质胶被稀释的越充分,越容易去除),4℃静置40min或-20℃放置5min(目的是使基质胶软化,如果冰箱保温效果强,缩短冷冻时间,摸索合适的冷冻时间时,可取出离心管摇晃看不到基质胶说明冷化好了)。
3)接下来将离心管进行300g,4℃,离心5min,离心完通常会有这两种情况:
第一种是正常情况,分成三层(如下图),此时弃掉上清和基质胶层,保留类器官沉淀即可。
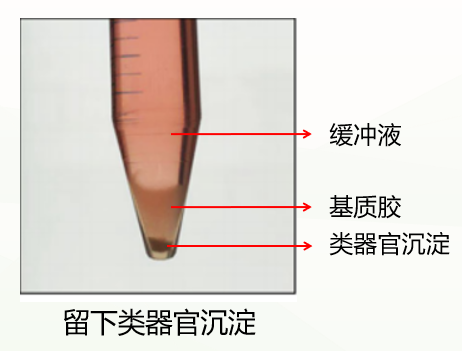
第二种是不正常情况,分成两层(如下图),这种情况可能与冷化不充分有关。此时弃掉缓冲液,留下基质胶类器官混悬液,重复上一步洗涤步骤,再次冷化离心,通常能出现清晰分层(缓冲液层、基质胶层、类器官沉淀层),此时弃掉上清和基质胶层,保留类器官沉淀即可。如果依然是两层(缓冲液层和基质胶类器官混悬液层),此时弃掉缓冲液和上1/3的基质胶类器官混悬液,保留下2/3即可。
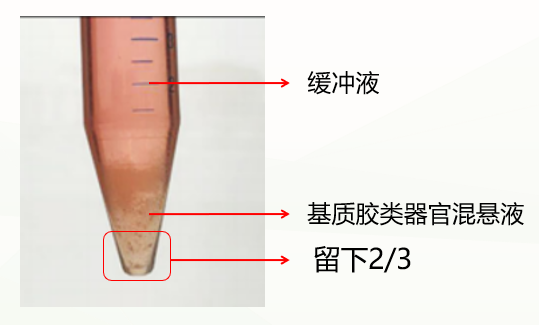
促进基质胶和类器官有效分离条件:
a 离心机的选择非常重要,水平角离心机相比固定角离心机更利于基质胶和类器官分离;
b 离心机的温度最好是4℃(可避免基质胶固化),离心转速可适当提高(最高不要超过500g),离心时间可适当加长(最常不超过10min)。
2、类器官消化
1)添加2-3mL类器官传代消化液D于超净台内消化2-3min,消化期间吹打1-2次。此步骤以消化成细胞团为主,千万不要消化成单细胞,单细胞类器官存活率低。如果不确定是否消化适宜,可吸取数微升镜下观察,如果有较多细胞团可停止消化。
2)添加5倍类器官传代培养缓冲液G(缓冲液:消化液=5:1)终止消化,300g 4℃离心5min弃去上清(如果有基质胶残留,残留量<50uL正常,不影响传代类器官增殖)

3、加胶-点板-加液
(1)准备工作
a 基质胶需用金属冰盒盛放在4℃冰箱过夜融化
b 枪头、离心管需要-20℃提前预冷至少半小时
c 融化后的基质胶可一直放4℃储存,建议2周内用完
(2)接种要求
24孔板(abs7035),每孔25uL基质胶细胞团混合物,500-750uL类器官培养液
(3)接种密度
密度建议1: 类器官通常按1:2传代,例如,24孔板收集5孔,传代10孔,需要的基质胶量25*10=250uL。
密度建议2:500个细胞团/25uL基质胶(如果想计数接种,可以参照此密度建议)
注意:不管是按密度建议1还是,密度建议2,如果有残留的基质胶,新胶量至少是残留胶量的1.5倍
(4)加胶-点板
向细胞团沉淀加入基质胶(abs9495),进行吹打混匀(不要满吹满打,容易产生气泡),然后进行点板。整个操作在金属冰盒或冰上进行。操作熟练以后,加胶,混匀,点板控制在半分钟内,有利于保持基质胶良好的流畅性。
(5)加液
将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μL人肠癌类器官培养基A进行培养。大概10-14天,多数类器官直径在200-300um,可进行传代操作。
二、类器官数量不足或体积较小时:
1、类器官收集、吹打、洗涤
(1)移液器吸去培养基,每孔添加1-2mL左右4℃类器官传代培养缓冲液G,轻柔吹散基质胶。
(2)进行吹打,将类器官吹成细胞团(可取样镜下观察有较多细胞团时可停止吹打);
(3)洗涤: 24孔板,每5孔为一组,收集在15mL离心管中,加类器官传代培养缓冲液G定容至14mL(缓冲液越多,基质胶被稀释的越充分,越容易去除),4℃静置 40min或-20℃放置5min(目的是使基质胶软化,如果冰箱保温效果强,缩短冷冻时间,摸索合适的冷冻时间时,可取出离心管摇晃看不到基质胶说明冷化好了)。
(4)接下来将离心管进行300g,4℃,离心5min,离心完通常会有这两种情况:
第一种是正常情况,分成三层(如下图),此时弃掉上清和基质胶层,保留细胞团沉淀即可。
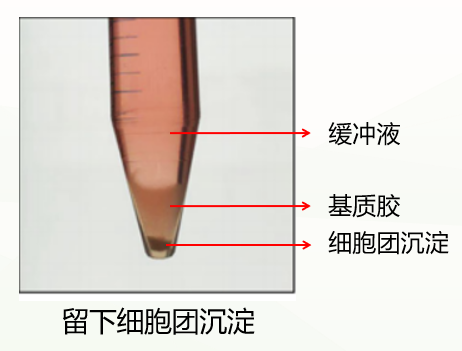
第二种是不正常情况,分成两层(如下图),这种情况可能与冷化不充分有关。此时弃掉缓冲液,留下基质胶类器官混悬液,重复上一步洗涤步骤,再次冷化离心,通常能出现清晰分层(缓冲液层、基质胶层、类器官沉淀层),此时弃掉上清和基质胶层,保留类器官沉淀即可。如果依然是两层(缓冲液层和基质胶细胞团混悬液层),此时弃掉缓冲液和上1/3的基质胶细胞团混悬液,保留下2/3即可。
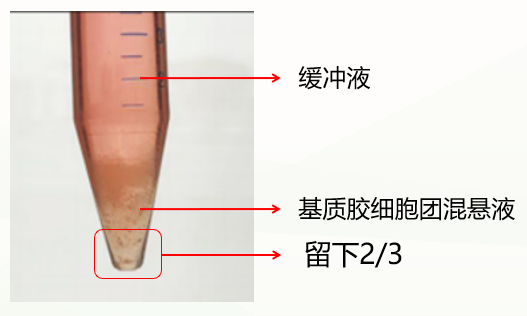
促进基质胶和类器官有效分离条件:
a离心机的选择非常重要,水平角离心机相比固定角离心机更利于基质胶和类器官分离;
b离心机的温度最好是4℃(可避免基质胶固化),离心转速可适当提高(最高不要超过500g),离心时间可适当加长(最常不超过10min)。
2、加胶-点板-加液
(1)准备工作
a 基质胶需用金属冰盒盛放在4℃冰箱过夜融化
b 枪头、离心管需要-20℃提前预冷至少半小时
c 融化后的基质胶可一直放4℃储存,建议2周内用完
(2)接种要求
24孔板(abs7035),每孔25uL基质胶细胞团混合物,500-750uL类器官培养液
(3)接种密度
密度建议1: 对于类器官数量较少的情况,为了维持生长所需的旁分泌信号,需要2-3孔富集到1孔,例如,24孔板收集6孔,2孔富集1孔,铺3孔,需要的基质胶量25*3=75uL。
密度建议2:500个细胞团/25uL基质胶(如果想计数接种,可以参照此密度建议)
注意:不管是按密度建议1还是按密度建议2,如果有残留的基质胶,新胶量至少是残留胶量的1.5倍
(4)加胶-点板
向细胞团沉淀加入基质胶(abs9495),进行吹打混匀(不要满吹满打,容易产生气泡),然后进行点板。整个操作在金属冰盒或冰上进行。操作熟练以后,加胶,混匀,点板控制在半分钟内,有利于保持基质胶良好的流畅性。
(5)加液
将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μL人肠癌类器官培养基A进行培养。大概7-10天,多数类器官直径在200-300um,可进行再次传代。
冻存
冻存要领:
类器官不需要消化(消化后的类器官复苏活率低);
在类器官指数增长期冻存(等到该传代的时候类器官活性比指数期差),也就传代后的Day3-Day4,多数类器官直径在100um-200um,这个时机选择冻存。
一、类器官收集及洗涤
1、收集:移液器吸去培养基,每孔添加1-2mL左右4℃类器官传代培养缓冲液G,轻柔吹散基质胶,收集在15mL离心管中(24孔板,每5孔为一组)。
2、洗涤:加类器官传代培养缓冲液G定容至14mL(缓冲液越多,基质胶被稀释的越充分,越容易去除),4℃静置 40min或-20℃放置5min(目的是使基质胶软化,如果冰箱保温效果强,缩短冷冻时间,摸索合适的冷冻时间时,可取出离心管摇晃看不到基质胶说明冷化好了)。
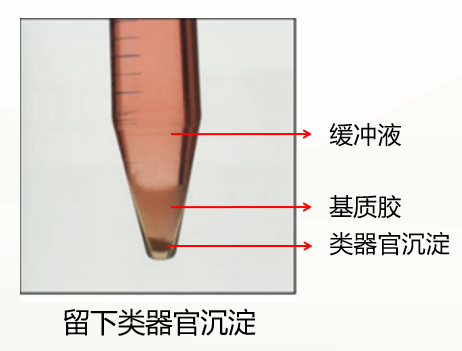
3、接下来将离心管进行300g,4℃,离心5min,离心完通常会有这两种情况:
第一种是正常情况,分成三层(如下图),此时弃掉上清和基质胶层,保留类器官沉淀即可。
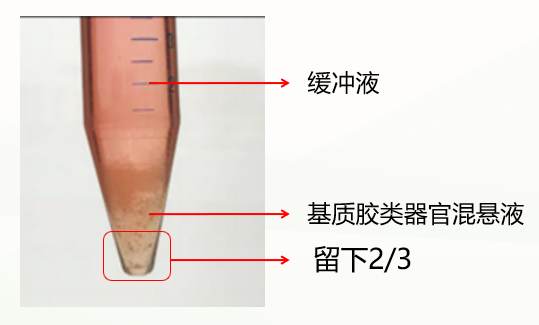
第二种是不正常情况,分成两层(如下图),这种情况可能与冷化不充分有关。此时弃掉缓冲液,留下基质胶类器官混悬液,重复上一步洗涤步骤,再次冷化离心,通常能出现清晰分层(缓冲液层、基质胶层、类器官沉淀层),此时弃掉上清和基质胶层,保留类器官沉淀即可。如果依然是两层(缓冲液层和基质胶类器官混悬液层),此时弃掉缓冲液和上1/3的基质胶类器官混悬液,保留下2/3即可。
促进基质胶和类器官有效分离条件:
a 离心机的选择非常重要,水平角离心机相比固定角离心机更利于基质胶和类器官分离;
b 离心机的温度最好是4℃(可避免基质胶固化),离心转速可适当提高(最高不要超过500g),离心时间可适当加长(最常不超过10min)。
二、类器官冻存
1、冻存密度,以24孔板为例
密度建议1:2孔/mL冻存液
密度建议2:500个类器官/mL冻存液(如果想计数冻存,可以参照此密度建议)
2、添加适量类器官冻存液F,轻柔吹打重悬,建议立即进行冻存。(放置太久,DMSO对类器官有损伤)
3、梯度冻存:将冻存管放入梯度冻存盒然后保存至-80℃过夜,第二天取出放入液氮罐。
手动冻存:4℃冰箱放置30min,转移至-20℃放置1h,然后移至-80℃过夜,第二天取出放入液氮罐。
复苏
一、实验前准备
1、将水浴锅预热至37℃;
2、细胞实验室进行常规消毒,用预防喷雾喷涂并且使用紫外线照射40min的超净工作台台面;
3、在超净工作台中按次序摆好消过毒的离心管、吸管、培养板等。
二、取出冻存管
1、根据类器官冻存记录按标签找到所需类器官的编号。
2、从液氮罐中取出冻存盒,取出所需的冻存管,同时核对冻存管外的编号。
三、迅速解冻
1、迅速将冻存管投入到已经预热的水浴锅中解冻,并要不断地摇动,使管中地液体迅速融化。
2、约1-2min后冻存管内液体完全溶解,取出用酒精棉球擦拭冻存管地外壁,再拿入超净台内。
四、将类器官冻存液移入15mL离心管,添加10倍体积类器官传代培养缓冲液G(缓冲液体积:冻存液体积=10:1)重悬,轻柔吹打混匀,300g 4℃离心5min,弃上清。
五、加胶-点板-加液
1、准备工作
(1)基质胶需用金属冰盒盛放在4℃冰箱过夜融化
(2)枪头、离心管需要-20℃提前预冷至少半小时
(3)融化后的基质胶可一直放4℃储存,建议2周内用完
2、复苏要求
24孔板(abs7035),每孔25uL基质胶类器官混合物,500-750uL类器官培养液
3、复苏密度
复苏密度建议1:1:1接种(原来冻几孔就复苏几孔)
复苏密度建议2:250个类器官/25uL基质胶(如果想计数接种,可以参照此密度建议)
4、加胶-点板
向类器官沉淀加入基质胶(abs9495),进行吹打混匀(不要满吹满打,容易产生气泡),然后进行点板。整个操作在金属冰盒或冰上进行。操作熟练以后,加胶,混匀,点板控制在半分钟内,有利于保持基质胶良好的流畅性。
5、加液
将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μL人肠癌类器官培养基A进行培养。大概10-14天,多数类器官直径在200um-500um,可进行传代操作。