概述
基质胶是从小鼠肿瘤组织提取的基底膜成分(基底膜是动物体内上皮细胞基底面的一层基质膜),所形成的基质胶。基质胶主要成分为层粘连蛋白,Ⅳ型胶原蛋白,巢蛋白。同时,基质胶也包含多种生长因子,例如表皮生长因子EFG,血小板衍生生长因子PDGF,神经生长因子NGF,碱性成纤维细胞生长因子FGF-2,乙型转化生长因子TGF-beta和胰岛素样生长因子ILGF(Vukicevic et al.1992)。
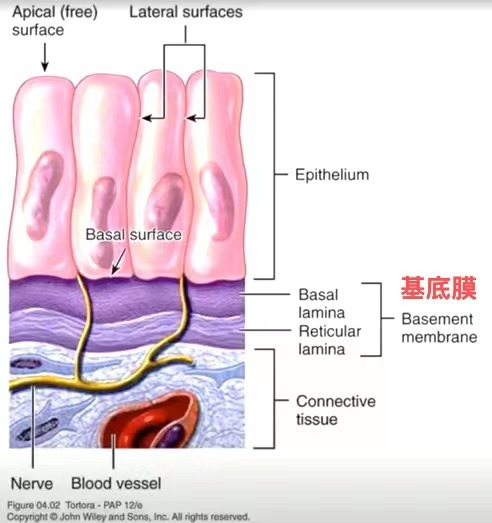
基底膜在小鼠肿瘤组织中的位置分布
基质胶在各实验领域中的应用
1、小鼠成瘤实验
动物实验由于其更能模拟人类的生理和病理条件,在肿瘤研究中,最常规的动物实验就是裸鼠成瘤实验。由于大部分肿瘤研究使用的是人类细胞,所以由于异种排斥的存在,我们需要免疫缺陷型小鼠来作为移植瘤模型的载体,通过对该小鼠的注射肿瘤细胞,使其成瘤,观察流体的生长来判断其生物学变化。
试剂材料
基质胶(高浓度,无酚红)(abs9493)
操作步骤
1)收集用于注射小鼠的细胞5*106个,以1:1的体积与基质胶混合,为方便注射,建议每次注射总体积不低于100µL;
2)用脱毛器对小鼠注射部位皮肤进行脱毛,然后用酒精棉球进行消毒;
3)用不带针头的1mL注射器将细胞和胶的混合物吸入针头,再装上16g的针头(针头内直径为1.194mm), 将混合物注射到皮下,或者大腿肌肉(针对代谢特别旺盛的肿瘤细胞)。
注意事项:
1)动物选择:一般选择4-6周龄Nude裸鼠,需要提前到SPF环境中适应1周;
2)接种部位与接种量:接种部位常为皮下,静脉或原位;细胞量一般是5*106个/200µL,但是不同的细胞系的接种量略有差别;
3)成瘤时间:皮下接种的细胞一般会在1-2周成瘤,一般不会超过1个月;尾静脉和腹腔接种的细胞一般也是1周左右,需要密切观察动物的体重与状态进行判断;
4)注射的时候一定要注意别打漏了或者打到肌肉里,这样出来的瘤体积一致性很差。一般采用进针以后针尖向上挑,打的体积不超过200µL。

基质胶成瘤对比实验
使用Absin高浓度基质胶,小鼠皮下瘤体积后期显著高于对照组和C品牌。
2、类器官培养
类器官属于三维(3D)细胞培养物,包含其代表器官的一些关键特性。此类体外培养系统包括一个自我更新干细胞群,可分化为多个器官器官特异性的细胞类型,与对应的器官拥有类似的空间组织并能够重现对应器官的部分功能,从而提供一个高度生理相关系统。类器官可以从成体干细胞(ASCs)、多能干细胞(PSCs)(即胚胎干细胞或ESCs),或诱导的PSCs(iPSCs)中衍生。类器官培养系统主要包括基质胶、维持类器官生态所需因子和分化所需因子这几个主要元素。基质胶中含有胶原、巢蛋白和纤连蛋白等等,为类器官形成三维空间结构提供基质。维持类器官生态因子主要目的为促进细胞的增殖和抑制细胞凋亡等。
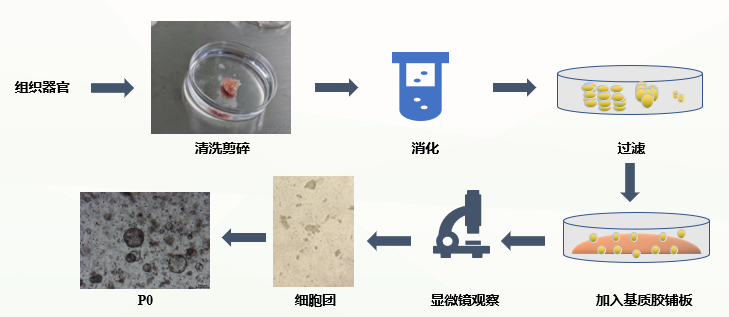
类器官培养流程
以人肠癌类器官培养为例
试剂耗材
人肠癌类器官培养基试剂盒(abs9445)、基质胶(低因子、无酚红)(abs9495)、60mm细胞培养皿(abs7005)、100μm滤筛(abs7009)、15mL离心管(abs7102)、1.5mL EP管若干(abs7119)、24孔细胞培养板(abs7058)、金属冰盒、眼科剪刀、眼科镊
人肠癌类器官培养基试剂盒(abs9445)
试剂盒组成
组分名称 | 规格 |
人肠癌类器官培养基A | 100mL |
类器官原代培养缓冲液B | 250mL |
人肠癌原代组织消化液C | 30mL |
类器官传代消化液D | 30mL |
组织保存液E | 100mL |
类器官冻存液F | 20mL |
类器官传代培养缓冲液G | 250mL |
基质胶(低因子、无酚红)(abs9495)
操作步骤
1)类器官操作流程之——样本准备
a.将组织放入含有预冷的(2-8°C)组织保存液E的取样瓶中(浸没整个组织),4℃从医院/实验室取回;
b.将取样瓶消毒,组织取出放入培养皿样本拍照,并登记大小,颜色,软硬程度,组织类型等信息。
2)类器官操作流程之——清洗-剪碎
在60mm细胞培养皿(abs7005)里用2-3mL原代培养缓冲液B浸泡。用原代培养缓冲液B清洗三次(每次更换培养皿)后剪碎,剪成大约1-3mm3的组织块,转移至15mL离心管。
3)类器官操作流程之——消化-过滤
a.向15mL离心管中加入人肠癌原代组织消化液C(消化液是组织体积的3-5倍)在37℃进行消化10-15min(消化过程中随时观察消化情况);
b.取少量液体在显微镜下观察,镜下观察到较多的细胞团(5-10个细胞抱团)后, 加入3倍体积原代培养缓冲液B终止消化,用枪头轻柔吹打可以看到液体变浑浊;
c.使用100μm滤筛(abs7009)进行过滤,取少量滤液在镜下进行观察。将滤液收集到15mL离心管,于300g 4℃富集离心5min后移去上清,添加1mL左右原代培养缓冲液B转移到1.5mL EP管,重新重悬离心。
4)类器官操作流程之—离心、加胶
基质胶计算:第3步后观察收集到的组织体积,添加25倍组织体积的基质胶(abs9495)重悬铺板(金属冰盒或冰上操作)。
5)类器官操作流程之——点胶-加液
以24孔细胞培养板为例,每孔点胶25uL组织基质胶混合物进行铺板(金属冰盒或冰上操作),将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μL人肠癌类器官培养基A进行培养。
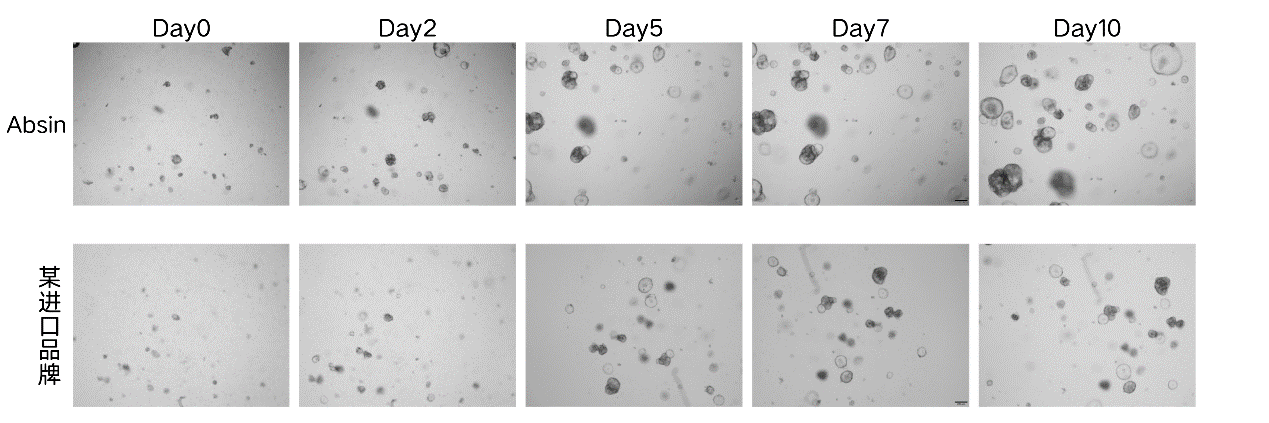
类器官培养对比
使用Absin低因子基质胶,肠癌类器官数量和体积显著大于某进口品牌。
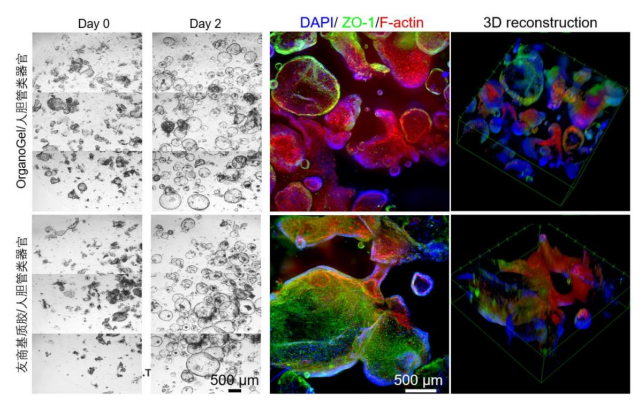
使用Absin低因子基质胶,肠癌类器官数量显著大于友商品牌且荧光染色类器官形态更完整。人胆管类器官由细胞核染料DAPI(蓝色),紧密连接蛋白抗体anti-ZO1和细胞骨架蛋白F-actin的染料 Alexa Fluor 647 Phalloidin染色成像。
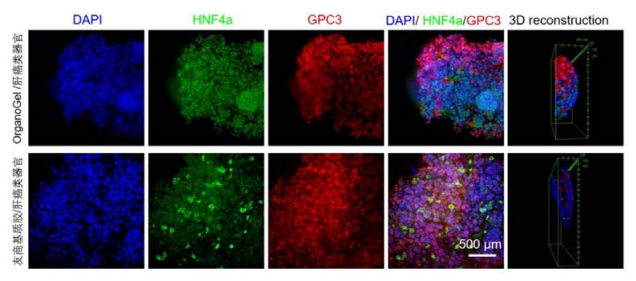
使用Absin低因子基质胶,肝癌类器官染色效果和友商品牌效果相当。肝癌类器官由细胞核染料DAPI(蓝色),肝脏细胞生物标志物HNF4a和肝癌标志物GPC3的抗体染色成像。
3、血管生成实验
血管生成(Angiogenesis)是指源于已存在的毛细血管和毛细血管后微静脉新的毛细血管性血管的生长。血管生成参与了需对疾病的病理变化,无论原发性肿瘤还是继发性肿瘤,一日生长直径超过1-2mm,都会有血管生成。这是由于肿瘤细胞自身可分泌多种生长因子诱导血管生成。控制血管生成有利于多种疾病的治疗,从病理学角度研究疾病状态下的血管生成和消退规律,采取有效的血管治疗策略以及开展器官转移等研究均有十分重要的意义。其中小管形成实验是测量在体外血管生成一种快速的可量化的方法。
以永生化HUVEC细胞系为例:
试剂材料
基质胶(标准型,无酚红)(abs9491)、胎牛血清(abs972)、HUVEC细胞(5*104 per well)、96孔细胞培养板(abs7036)、青霉素-链霉素溶液(100×,双抗)(abs9244)、DMEM高糖培养基(含L-谷氨酰胺,含丙酮酸钠,不含HEPES)(abs9483)
实验步骤
1)将完全培养基换成饥饿细胞用培养基:加入含0.2% FBS,1%双抗的DMEM培养基培养24h;
2)将基质胶均匀铺满96孔板底。
注意:枪头需提前预冷30min。尽量在冰上操作,避免基质胶过早固化,避免气泡产生;
3)将96孔板在细胞培养箱孵育30min,固化基质胶;
4)消化HUVEC细胞,并计数;
5)将200µL的HUVEC细胞悬液(含5*104个细胞)加于含基质胶的96孔板中。将96孔板放于培养箱;
6)血管样网络结构将于3-12h形成;
7)在血管网络形成最佳时间,小心去除培养基,并用加入含活细胞染料1/1000 Calcein AM(绿色)的培养基进行染色,并用显微镜进行拍照记录。
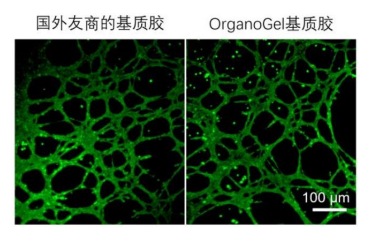
使用Absin标准型基质胶以及外友商基质胶,均可使人脐静脉内皮细胞(HUVEC)形成血管网络。
4、细胞侵袭
Transwell细胞体外侵袭实验应用于各种细胞因子对恶性肿瘤细胞侵袭和转移的影响及一些抑制血管生成的新药研究。Transwell实验原理就是将transwell小室放入培养板中,并将高营养液与低营养液用一层膜隔开,细胞放在低营养液中,而为了获得更多的营养,细胞则会穿过这层膜,进入高营养液。细胞transwell实验,可作为一种非常简便的研究肿瘤细胞迁移、侵袭以及转移情况的方法。
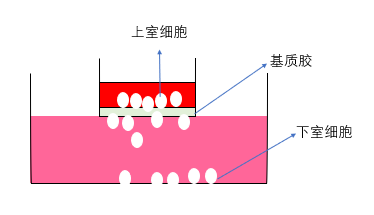
细胞侵袭实验原理图
实验材料
基质胶(标准型,无酚红)(abs9491)、胎牛血清(abs972)、PBS(abs962)、BSA(abs9156)、DMEM高糖培养基(含L-谷氨酰胺,含丙酮酸钠,不含HEPES)(abs9483)、24孔板细胞培养小室配套培养板(abs7282)、上层培养液:DMEM加入0.05%-0.2%BSA、下层培养液:DMEM加入5%-10%FBS
实验步骤
1)铺基质胶:在4℃条件下将基质胶用无血清的细胞培养基或PBS缓冲液按照1:8比例稀释(其稀释比例需要摸索,选择一个细胞穿过适中的浓度即可),取100uL均匀涂抹于上室的聚碳酸酯膜表面,37℃放置0.5-1h,使其聚合成凝胶。
注意:
a.将枪头沿小室内壁将基质胶轻轻打出,切忌戳到小室滤膜;
b.加入的基质胶的体积不可太大。把聚碳酸酯膜浸湿即可;
c.注意低温,枪头、小室等都应该4℃预冷。
2)细胞培养:取对数生长期的待测细胞,并用PBS洗涤,接着用上层培养基(DMEM加入0.05%-0.2%BSA)悬浮细胞,调整细胞密度为1-10*105/mL。
3)接种细胞:在24孔板下室一般加入500-650uL下层培养液(DMEM加入5%-10%FBS),然后用镊子将Transwell小室置于24孔板内,取细胞悬液100-200µL加入上室,最后放入培养箱中培养12-48h(根据癌细胞的转移能力而定)。
注意:
a.尽量避免气泡的产生:下层培养液和小室间常会有气泡产生,会影响下层培养液的趋化作用。因此一旦出现大气泡,要将小室提起,去除气泡,再将小室放进培养板;
b.注意细胞一定要接种均匀,建议沿着壁缓慢加入;
c.时间点的选择除了要考虑到细胞的转移能力以外,处理因素对细胞数目的影响也不可忽视如某些药物会抑制细胞的增殖。
4)细胞固定:取出小室,吸走培养基,用棉签轻轻擦拭基质胶和上室内的细胞。取新的24孔板加入4%多聚甲醛600µL,将小室放入后固定20-30min。
5)细胞染色及计数:弃固定液,用0.1%-0.2%结晶紫染色5-10min, PBS洗3遍,除去未与细胞结合的结晶紫,用棉签轻轻擦拭小室的上侧,将非特异性结合于小室上表面的染料擦掉,以便后续镜检。适当风千后,在高倍显微镜下选取5个视野观察细胞并计数。
常见细胞每孔接种数量推荐(仅参考)
细胞名称 | 细胞接种量 | 检测时间点 |
DU145 | 3*104 | 24h |
PC3 | 5*104 | 24h |
A549 | 8*104 | 48h |
22RV1 | 8*104 | 72h |
5、细胞迁移
细胞迁移和细胞侵袭实验方法相似,区别点在于细胞迁移不需要基质胶包被。
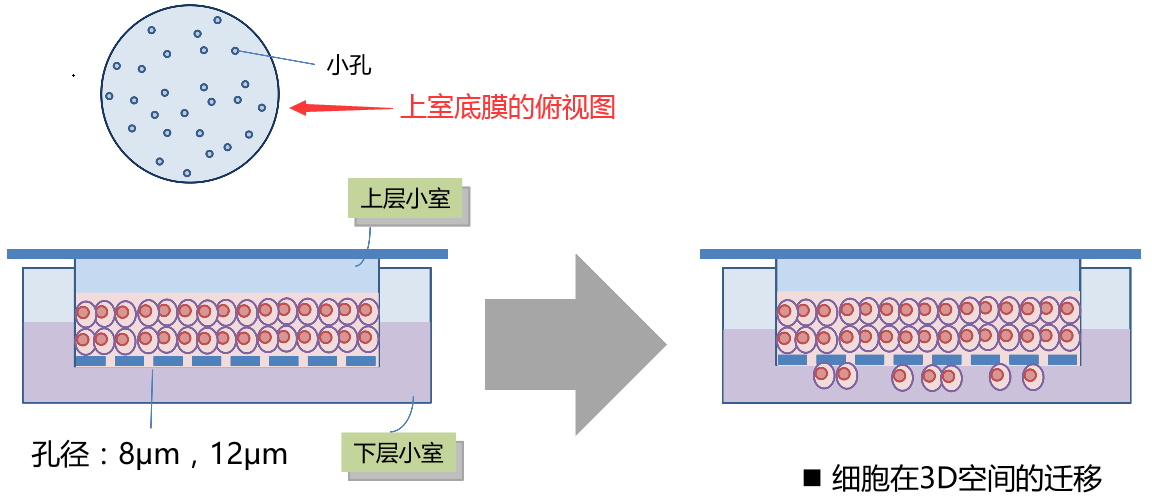
细胞迁移实验原理图
实验试剂
胎牛血清(abs972)、DMEM(abs9483)、PBS(abs962)、BSA(abs9156)、24孔板细胞培养小室配套培养板(abs7282)、上层培养液:DMEM加入0.05%-0.2%BSA、下层培养液:DMEM加入5%-10%FBS
实验步骤
1)细胞培养:取对数生长期的待测细胞,并用PBS洗涤,接着用上层培养基(DMEM加入0.05%-0.2%BSA)悬浮细胞,调整细胞密度为1-10*105/mL。
2)接种细胞:在24孔板下室一般加入500-650uL下层培养液(DMEM加入5%-10%FBS)(有些特殊实验可以加趋化因子)。然后用镊子将Transwell小室置于24孔板内,取细胞悬液100-200µL加入上室,最后放入培养箱中培养12-48h(根据癌细胞的转移能力而定)。
注意:
a.尽量避免气泡的产生:下层培养液和小室间常会有气泡产生,会影响下层培养液的趋化作用。因此一旦出现大气泡,要将小室提起,去除气泡,再将小室放进培养板;
b.注意细胞一定要接种均匀,建议沿着壁缓慢加入;
c.时间点的选择除了要考虑到细胞的转移能力以外,处理因素对细胞数目的影响也不可忽视如某些药物会抑制细胞的增殖。
3)细胞固定:取出小室,吸走培养基,用棉签轻轻擦拭上室内的细胞。取新的24孔板加入4%多聚甲醛600µL,将小室放入后固定20-30min。
4)细胞染色及计数:弃固定液,用0.1%-0.2%结晶紫染色5-10min,PBS洗3遍,除去未与细胞结合的结晶紫,用棉签轻轻擦拭小室的上侧,将非特异性结合于小室上表面的染料擦掉,以便后续镜检。适当风千后,在高倍显微镜下选取5个视野观察细胞并计数。
*注:文中部分图源于网络,仅供学习参考用。
本期小爱推荐
货号 | 品名 | 规格 | 货期 | 应用 |
abs9490 | 基质胶(标准型,含酚红) | 1.5mL×4 | 现货 | 类器官培养;细胞侵袭;细胞迁移 |
abs9491 | 基质胶(标准型,无酚红) | 1.5mL×8 | 现货 |
abs9492 | 基质胶(高浓度,含酚红) | 1.5mL×8 | 现货 | 小鼠皮下成瘤;血管生成;凝胶栓塞 |
abs9493 | 基质胶(高浓度,无酚红) | 1.5mL×4 | 现货 |
abs9494 | 基质胶(低因子,含酚红) | 1.5mL×4 | 现货 | 类器官培养;与生长因子、信号途径等相关的研究 |
abs9495 | 基质胶(低因子,无酚红) | 1.5mL×4 | 现货 |
abs9497 | 基质胶(高浓度,低因子,含酚红) | 1.5mL×8 | 现货 | 小鼠皮下成瘤;血管生成;凝胶栓塞;与生长因子、信号途径等相关的研究 |
abs9498 | 基质胶(高浓度,低因子,无酚红) | 1.5mL×8 | 现货 |
abs9496 | 基质胶(IPS验证无酚红) | 1.5mL×4 | 现货 | 包被孔板,适用于人胚胎干细胞hES、诱导多能干细胞IPS 的扩增和维持 |
abs9410 | 即用型基质胶 | 100mL | 现货 | 包被孔板,适用于难贴壁细胞(如293T,HUVEC)的扩增和维持
|