简述:
流式细胞术是一种基于荧光的检测的技术,能同时测定悬浮于溶液中的单个细胞的多种特性,例如细胞群计数和蛋白丰度。流式细胞术使用荧光偶联抗体直接检测抗原,每种抗体对应细胞内或细胞表面的不同蛋白,可实现细胞特性的快速、定量和准确测定,并且提供针对细胞群异质性的卓越解读,主要优势在于,它可以同时分析细胞群中的多个参数和多个不同的细胞标志物。
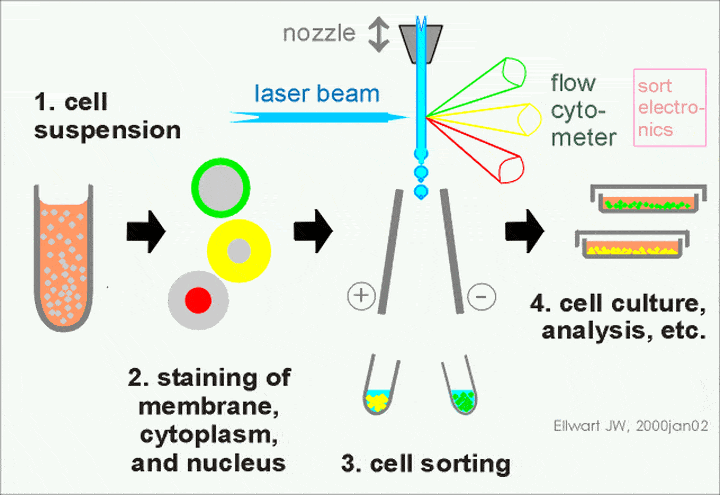
图1 流式示意图
样本处理:
针对流式细胞分析进行的样品制备是一个关键步骤,样本制备的好坏对最终的检测结果有很大的影响。常见的的样本多为外周血、骨髓、脑脊液、胸水、腹水以及淋巴结、脾、肝等,不同类型的样本最好在12h内进行处理,若无法及时处理,4℃保存,保存时间因样品而异,最好不超过48h。
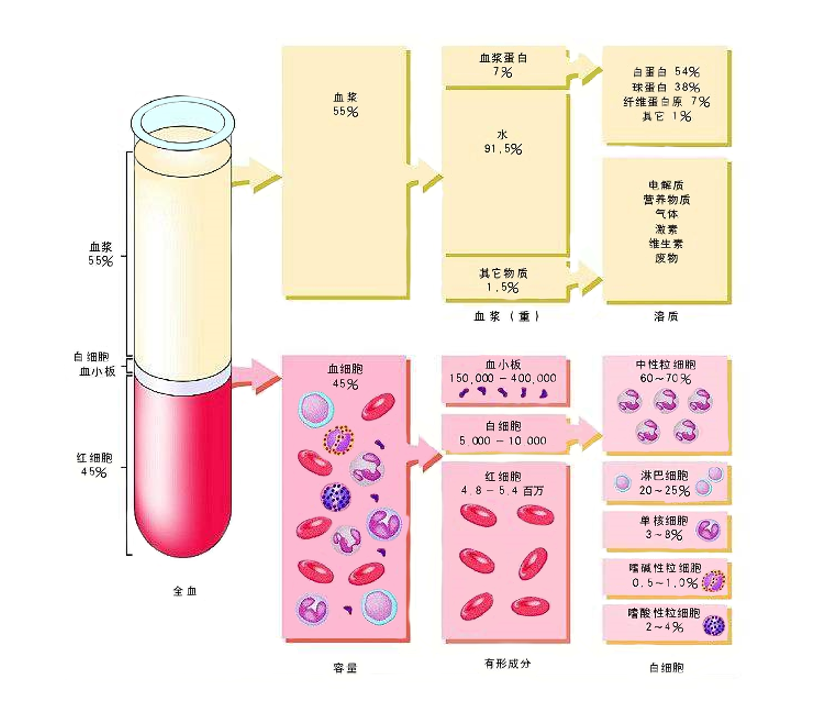
图2 血液成分
1、样本收集后置于含抗凝剂(一般选择肝素或EDTA)的试管中;
2、在15mL无菌离心管中加入淋巴细胞分离液(abs930) 5mL;(注意:淋巴细胞分离液使用前需恢复室温,18-25℃)
3、Hank's液 (abs9257)或PBS缓冲液(abs962) 1:1比例(如果全血样本粘稠,可适当增大比例)稀释抗凝过的全血样品;
4、小心沿着壁管,接近分离液层面,非常缓慢地加入新鲜的稀释过的4mL全血样品在淋巴细胞分离液上面;(注意:切记不要搅浑淋巴细胞分离液)
5、小心放进离心机(水平转子),4℃离心20-30min,速度为400g-1000g;(注意:离心机刹车应取消,需等待自然停止)
6、取出离管,切记不要震动。可见上层为淡红色透明血浆,其次为薄薄的只密白色环,白色环卫单核细胞淋巴细胞;
7、弃上层,吸出PBMC层,加入PBS,洗1-2次。300g,10min,离心去上清,加入抗体进行染色。

图3 abs930人淋巴细胞分离液
脑脊液、胸水、腹水等体液:
1、样本收集至抗凝管中,室温或4℃保存;
2、样本1000-1500rpm离心5min,弃去上清;
3、加入含有0.1%牛血清白蛋白的PBS,1000-1500rpm离心5min进行洗涤;
4、加入适量PBS重悬。如有细小沉淀,用40um细胞筛网(300目,蓝色) abs7231过滤后备用。
淋巴结、脾、肝等组织:
组织样品比较常用酶消化和机械破碎的方法处理成单细胞悬液。程序参照细胞培养单细胞的制备,注意可用800-1000rpm 低速离心3min去除细胞碎片的影响。
封闭(abs9476)或(abs9477)
D16是低吸附的IgG FC受体 III(FcR III),CD32是FC受体 II(FcR II),CD16/CD32表达于B细胞、单核细胞、NK细胞、粒细胞、肥大细胞、树突状细胞(低水平)、Kupffer细胞、未成熟胸腺细胞和某些活化的成熟T淋巴细胞。FcR表达细胞在免疫荧光染色中有时出现假阳性或假阴性结果,原因在于FcRs介导的Ig Fc结合性。
为阻断Fc受体,100µL染色体积按照每106个细胞加入0.25µg小鼠Fc受体阻断剂,混匀,冰上孵育5-10min,之后用抗体进行染色。在此封闭和免疫染色步骤之间没有必要进行细胞清洗。
固定(abs9110)、破膜(abs9111)
1、收货待测细胞(流式细胞实验,一般的细胞量就是控制在5*106-107个cell/mL; 做流式每管的细胞量可取100uL),1000rpm离心10min,弃上清;
2、加入500uL 4℃预冷的固定剂;
3、室温避光孵育10min;
4、1000rpm离心10min;
5、弃上清,加入PBS洗一次,1000rpm离心10min;
6、弃上清,加入1.5mL破膜剂;
7、室温孵育10-15min;
8、1000rpm离心5min;
9、弃上清,加入适量(100uL左右)破膜剂(注意加入的是破膜剂而非PBS)重悬细胞;
10、加入检测抗体染色后,用流式细胞仪进行分析。
流式细胞常见问题
1、所有样本在检测之前都需要固定吗?
我们一般在检测胞内指标时需要固定破膜,特殊情况下,染完胞膜指标已经到很晚,可以对样本进行固定处理,4℃放到第二天检测,保持检测指标的稳定性(如果染色的抗体颜色是耦联染料(PE-Cy5、PE-Cy7、PerCp-Cy5.5)不能固定,因为耦联染料在固定时会解偶联,这会导致荧光染料降解。),当样本特别多的时候,间隔会很久,这种情况下上机前也可以做一下固定,保持前后数据的一致性,此外,在蛋白翻译后修饰,如磷酸化、乙酰化、甲基化等的研究过程中,固定剂可以固定住翻译后修饰的位点,也可以防止目标位点在活细胞中很快降解。
2、细胞染色缓冲液(abs9475)和pbs相比有什么优点?
staining buffer是一种缓冲盐水溶液,可用作抗体和细胞稀释步骤,以及细胞表面染色和流式细胞分析的所有清洗步骤,含胎牛血清,减少抗体和荧光素对目的细胞的非特异性结合;还含叠氮钠,是一种代谢抑制剂,能抑制细胞表面抗原的成斑和成帽现象。
成斑和成帽现象:在荧光免疫标记试验中,两种膜蛋白荧光抗体混合后,由于膜蛋白的流动性,一段时间后,两种荧光蛋白抗体均匀分布在质膜上。时间继续延长,抗体在细胞表面会重新分布,聚集在细胞的一定部位即所谓的成斑现象。经过一段时间后,二价抗体在细胞膜表面相互交联使被标记的膜蛋白集聚在细胞的一端,即成帽现象。
3、用了Fc受体阻断剂还需要做同型对照吗?
同型对照抗体相当于没有特异靶标的一抗作用是排除非特异性结合,包括:抗体与靶细胞上的 Fc受体结合;抗体与细胞蛋白、碳水化合物和脂类的非特异性结合和。但是有很多种细胞的FC受体能结合FC段(表达DC64,CD32,CD16的细胞结合力较强),同型抗体能与FC受体结合,但是结合能力和一抗是一样的,
抗体与细胞蛋白、碳水化合物和脂类的非特异性结合,Fc受体阻断剂解决不了,实际实验中有些抗体较难找到同型抗体。而且,Fc受体阻断剂相对比较便宜,是比较好的选择。
流式辅助试剂推荐: