来宝网 2022/8/3点击823次
背景
本文旨在证明使用对比增强OCT可以在活体内进行功能成像。根据之前研究,使用大的适用于生物用途的GNRs(约100× 30 nm,即LGNRs)作为OCT造影剂。使用SD-OCT(Spectral Domain OCT)系统和定制的光谱算法,活体内检测了这些GNR试剂。发现LGNRs每粒子产生的光谱信号是传统GNR的约110倍,且活体内LGNR检测灵敏度可达至少250 pM。使用该系统无创成像观察了肿瘤组织中750 μm深度的小血管(直径约20 μm),以及小鼠耳淋巴网络中液体引流的空间模式。除此之外,对比增强型OCT图像还用来确定维持单向淋巴流动的淋巴管的位置和功能状态。为体内靶向分子成像研究提供了一个理想的平台。
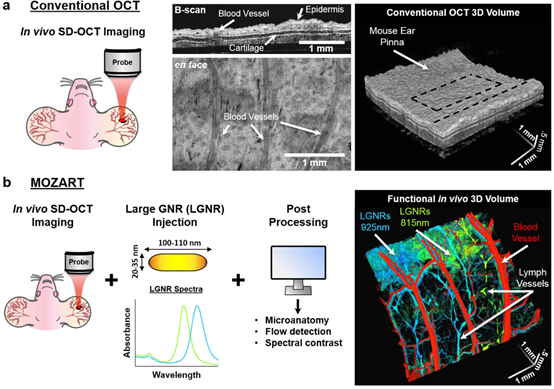
图1 MOZART及其活体内成像能力总览。(a)传统OCT扫描小鼠耳廓。(b)MOZART结合使用SD-OCT和造影剂LGNR,以及定制的处理算法,产生的图像包含体内功能性信息。MOZART图像以不同光谱展示皮下注射的LGNR,引流到淋巴管为绿色和青色,引流到血管为红色。
结果
01-后处理算法
OCT依靠低相干光干涉来检测样品中散射体的位置,SD-OCT则是通过对获得的干涉信号光谱进行傅里叶变换来确定散射体位置,这种标准方法产生的图像带有纯粹的结构信息(图2a)。研究人员结合定制处理算法,将原始的SD-OCT干涉图分成两个光谱不同的子集即Band 1和Band 2,大致对应900-1000 nm和800-900 nm的波长范围(图2c)。分别重建两个子集的干涉图,从总干涉图重建的OCT图像中减去它们并除以OCT图像。将重建波段之间的差异定义为光谱信号,将重建波段之间的归一化差异定义为光谱对比度(图2d)。
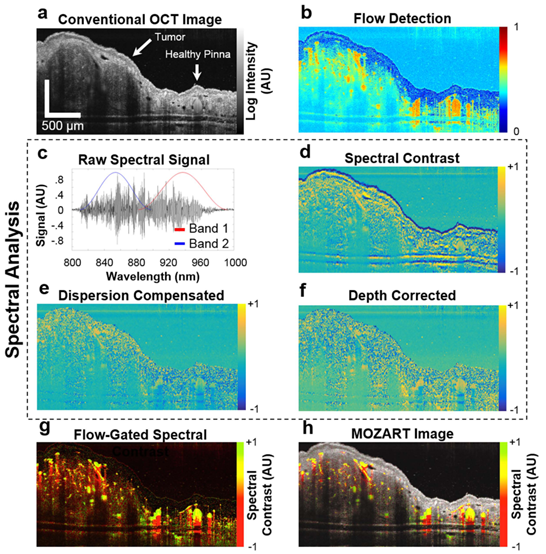
图2 后处理步骤及结果。(a)OCT对数强度图像,展示IV注射LGNR后耳廓中肿瘤的结构。(b)流动检测算法结果。图像中含血管下的垂直阴影,是散斑方差法检测流动的典型伪影。(c)干涉图被分成两个波段,以实现双波段检测LGNR。(d)光谱对比度的对数表示。(e)迭代色散补偿后的图d。(f)应用深度相关增益的图e,以补偿深度相关光谱像差。(g)血流检测与光谱对比度相结合,产生注射LGNR后肿瘤血管的光谱图。血管中的LGNRs显示为黄绿色。由于血管下方组织的光谱中性,LGNRs下方区域呈现红色。(h)图g结合OCT强度信号以显示组织解剖结构。
在OCT中,当光通过色散介质时,样品臂和参考臂之间的光程长度不匹配会导致色散,OCT系统中的光学元件和样品本身也会导致色散。可在后处理图像重建期间通过添加与波数成平方关系的相位进行色散补偿,此外还有光谱伪影,因此研究人员也开发了自适应方法进行相应补偿(图2e,f)。
02-LGNR造影剂在OCT中的应用
本研究合成了一种较大的GNR(LGNR),尺寸约100× 30 nm的LGNR,通过透射电子显微镜测量发现,LGNRs在815 nm处显示出纵向表面等离子体共振(LSPR)峰值,并且消光系数比等效等离子体共振的常规GNRs大约8倍(图3a)。还制备了另一批925 nm LSPR的LGNRs用于多重研究。
除光散射强度外,生物稳定性和无毒性也至关重要。研究人员用methoxy-PEG-SH包被LGNRs-PSS,即PSS(poly sodium 4-styrenesulfonate,MW约70 kDa)温育LGNRs产生的颗粒,在DDI H2O和FBS中都非常稳定,随后洗涤以产生LGNRs-PSS-mPEG,确保生物相容性和无毒性。将LGNRs-PSS-mPEG用于所有淋巴成像实验。还制备了由非特异性IgG1抗体包被的LGNRs-PSS(LGNRs-Ab),用于进一步的分子靶向实验,同时也证明了LGNRs-PSS的广泛应用性,可以很容易地用抗体进行修饰。

图3 GNR和LGNR对比的评估。(a)相同的纳米粒子浓度(nps/ml)下,LGNRs的总消光比传统GNR大约8倍。(b)以同等的粒子浓度(1× 1010 mps/ml)制备时,LGNR的OCT信号比GNR大得多。(c)对b中标出的区域进行的定量分析表明,LGNR的OCT强度比GNR强约30倍,光谱信号比GNR强约110倍(*p< 0.001)。(d)血液中LGNR浓度增加的对数OCT强度。(e)d中样品的光谱对比度,显示随着LGNR浓度的增加,光谱色调从红色增加到黄绿色。虚线为用于光谱对比度量化的区域。(f)血液中LGNR浓度的光谱对比度的量化。
使用本文的光谱处理算法,能够检测到水溶液中的单个LGNR(图2b)。在OCT图像中观察到的亮点数量与成像体积中给定LGNR浓度下单个粒子的预期数量一致。
使用新采集的大鼠全血进行体外成像灵敏度探究,发现使用该系统光谱分析方法检测LGNR的灵敏度为50 pM(p< 0.001),表明LGNRs容易产生在生物背景中可区分的OCT光谱对比度(图3d-f)。
通过对小鼠肿瘤异种移植模型成像,证明该系统在活体内检测LGNRs的能力。在雌性裸鼠(nu-/nu-)右耳耳廓接种U87MG细胞。肿瘤细胞注射后7天,以20 μL的增量静脉注射LGNRs-Ab(250 μL,浓度23.5 nM),每次注射后获取截面OCT图像,并测量血管中的光谱对比度。研究发现,虽然血管最初表现出中性光谱信号,但注射LGNR-Ab后,血管中观察光谱偏差强烈朝向LGNR-Ab峰(图4a)。光谱分析能够检测小鼠耳脉管系统中低至250 pM(p < 0.001)浓度的LGNRs-Ab(图4b)。药代动力学方面,基于注射后24h内的光谱定量,LGNRs-Ab的光谱对比循环半衰期(t1/2)约为18h(图4c),因此抗体修饰的LGNRs在分子靶向研究中也有很大的应用潜力。
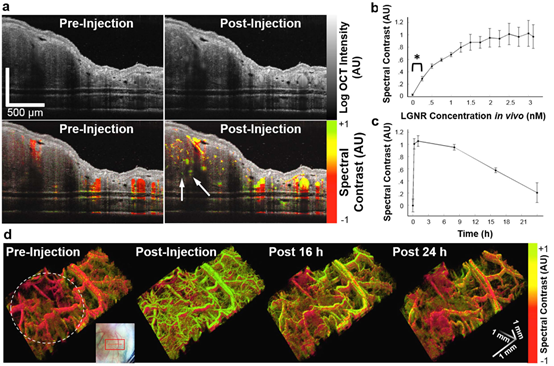
图4 体内肿瘤模型中OCT图像的对比度增强。(a)静脉注射LGNRs-Ab前后的OCT对数强度图像和组合光谱对比图像。在血管中检测到LGNRs-Ab,注射前为红色,注射后为黄绿色。LGNRs-Ab增强了观察肿瘤深处小血管的能力(白色箭头)。(b)在LGNRs-Ab静脉递增注射期间血管中的光谱信号。能够从第一次增量注射中检测到LGNRs-Ab,相当于血液中LGNRs-Ab浓度为250 pM(*p< 0.001)。(c)静脉注射LGNRs-Ab前和注射后24h血管中的光谱信号。(d)注射LGNR-Ab前及注射后0、16、24 h肿瘤血管(白色虚线圈出)和邻近健康组织中光谱对比信号的3D体积视图。
体积式OCT图像显示,在注射LGNR-Ab前,健康耳组织和肿瘤组织之间的血管形态存在差异,而健康血管系统和肿瘤血管系统的信号在光谱上都是中性的。注射LGNR-Ab后,两者脉管系统中都观察到光谱对比度显著增加,且由于LGNRs-Ab的反向散射增加,还可观察到许多额外的小血管,特别是在肿瘤内部(图4d)。
有研究使用OCT来识别淋巴管网络,但无法提供关于功能性淋巴流动的信息,如引流的组织区域或淋巴流动方向。研究人员使用MOZART系统对小鼠耳廓初始淋巴管中液体引流的空间依赖性进行成像。在注射之前采集的流动门控OCT图像描绘出血管系统(图5a)。注射815 nm的LGNR-PSS-mPEG(2 μL,浓度8.5 nM)后,立即观察到广泛的引流淋巴管网络,直径小至约20 μm(图5b)。30 min后,在距离第一个注射部位约1 mm处注射光谱不同的925 nm LGNRs-PSS-mPEG(2 μL,浓度8.5 nM)。使用光谱分析来区分两种LGNR,观察到几个之前看不到的淋巴管从925 nm LGNR注射部位引流。有趣的是,在第一次注射后显示出强815 nm LGNR信号的几个淋巴管在第二次注射后,显示出925 nm LGNR信号或混合LGNR信号。一些包含混合光谱信号的淋巴管显示出离散的光谱对比度,而不是两个LGNR光谱的平均值(图5c)。

图5 LGNRs-PSS-mPEG引流到耳廓淋巴管的活体内研究。(a)流动检测的正面视图,显示注射前的血管(红色)。(b)光谱对比显示第一次注射815 nm LGNR(绿色)。(c)第二次注射925 nm LGNR后(青色-蓝色)。LGNRs正在填充淋巴管,并从耳边缘的注射部位(图像顶部)引流向耳朵底部(图像底部)。(d)另一只小鼠左侧注射815 nm LGNR后的正面图。(e)d中虚线区域的特写图,显示淋巴网络中的连接。可以清楚观察到相邻淋巴管之间瓣膜的位置(白色箭头)。(f)与e同一个区域注射925 nm LGNR后。815 nm和925 nm LGNRs都到达淋巴连接。连接处左侧的淋巴管仍含有815 nm LGNR(绿色),而右侧以前未发现的淋巴管和连接处下游的淋巴管显示925 nm LGNR(青色-蓝色)。
结论
参考文献
Liba, Orly , et al. "Contrast-enhanced optical coherence tomography with picomolar sensitivity for functional in vivo imaging." Scientific Reports 6(2016):23337.




