来宝网 2023/1/3点击1106次
前文我们已经介绍过,PROTAC 分子由靶蛋白配体、E3 连接酶配体和两者中间的连接段组成,设计 PROTAC 之初,三者应该分别考量。
■ 靶蛋白配体
在实际设计工作中,往往先会选择好目标蛋白。靶蛋白的挑选可以从以下几点考虑:
1、该蛋白是否具有特异性, 非特异性蛋白会造成脱靶毒性;
2、该蛋白是否属于 PROTAC 分子常规的降解蛋白 (PROTACable 靶点增加 PROTAC 设计的有效性), 2021 年,Nature Reviews Drug Discovery 杂志报导了一篇利用 PROTACtability 方法评价蛋白靶点的可PROTACable的文章,文章最后提出值得 PROTAC 化的靶点包括了激酶 (MEK、KRAS、CDK 和 Bcr/Abl)、转录因子 (如 p53、STAT、RAR、ER 和 AR)、表观遗传因子 (如 HDAC 和 BET 溴结构域)和 E3 连接酶本身 (如 MDM2) 等。
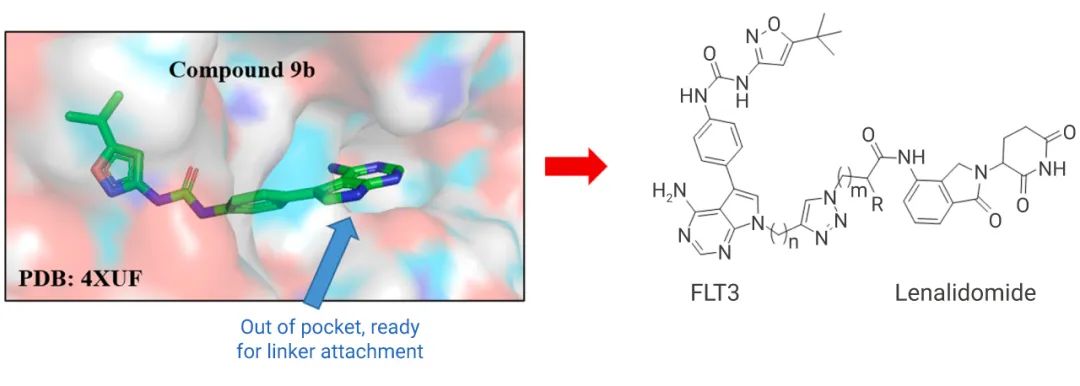
3、该蛋白是否有相关的配体或晶型报道,这是考虑到商业化设计 PROTAC 的效率性,如目前临床二期的两个已知结构的 ARV-471和 ARV-766 结构分别源自于 Tamoxifen 和 (+)-JQ-1。
上述三点均满足时,常规的 PROTAC 设计便可进行:从靶点已知的相关配体分子构效关系总结出它不影响结合的适合改造的位置,或是有蛋白的晶体模型可被用于虚拟筛选从而缩小后续高通量筛选的范围。
当然,在实际设计中,往往还会遇到靶蛋白本身的内源性配体:多肽、DNA、糖链等,基于此也有相关的 p-PROTAC 被开发 (多肽-PROTAC),笔者认为基于肽段的 PROTAC 可能是该项技术发展的一个方向:目前传统 PROTAC (小分子为主) 需要前期配体的构效关系研究以确定基础决定连接位置,但单纯用蛋白本身的多肽配体则不需要这个,大多数多肽可连接的位置在 C 端或者 N 端。
当然,若是从头设计 PROTAC (没有成熟配体报道的靶蛋白),要考虑的就不仅仅是上述问题了,结合腔、突变、其它变构位点、可逆共价结合等种种因素都需要深入研究,总结起来则是一个药化课题的体量。
首先,来看 E3 连接酶配体,对于 E3 连接酶配体目前常规使用的还是 CRBN 和 VHL 两种配体。从流程上来讲,原则上需要通过 E3 连接酶试剂盒的确定靶细胞中 E3 连接酶的丰度,从而选择最佳的 E3 连接酶配体。但目前这一块目前的研究涉及仍然不是很多,一般而言,商业化的设计只是选择经济易得的 CRBN 和 VHL 配体分子。
图 3. 常见的 E3 连接酶及其配体[6]
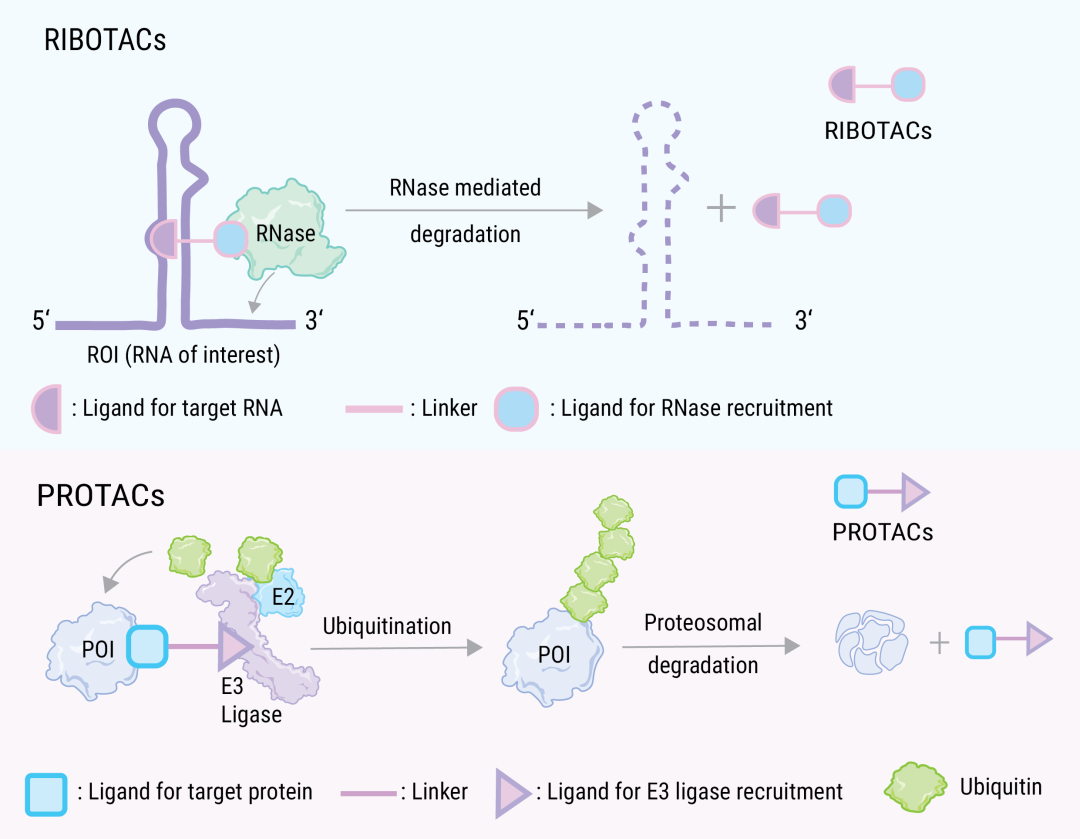
随着对 PROTAC 技术的深入研究,目前对 E3 泛素连接酶配体的筛选也开始进入科学家视野。在 “三元降解复合分子” 的模式下,也出现了比如基于 RNA 酶的 RIBOTAC (其功能是将目标 RNA “带到” RNase进行降解)、基于溶酶体的 ATTEC (既可以与自噬过程中的关键蛋白 LC3 结合,也可以与靶蛋白结合,将靶蛋白绑定至自噬小体进行降解)、LYTAC(干货丨药界新宠—— LYTAC 与靶向蛋白降解技术) 和自噬介导的降解剂 AUTAC 等,它们补充了 PROTAC 的降解范围,使靶向降解可以作用于更多方面。结构上设计思路不变,只是对 E3 连接酶配体做相应的替换。
图 4. 利用 RNA 酶靶向降解 ROI 的 RIBOTAC[7]
a. RIBOTAC 是一个二价分子,包含 RNA 结合模块 (紫色),核糖核酸酶 (RNase) 招募模块(蓝色)和一个连接子 (粉线); RIBOTAC一旦与靶 RNA 结合,就会在靶 RNA 附近招募 RNase,从而促进其降解。b. PROTAC 降解机制。
最后让我们看看看似简单的 Linker 分子。初步的 PROTAC 设计常常会选择 PEG 链作为连接分子。PEG 链具有足够的柔性,可以调整分子到适宜的结合角度,但也正由于 PEG 链的柔性,让分子的结合熵过高,这一点在后期的优化中需要将之改善。
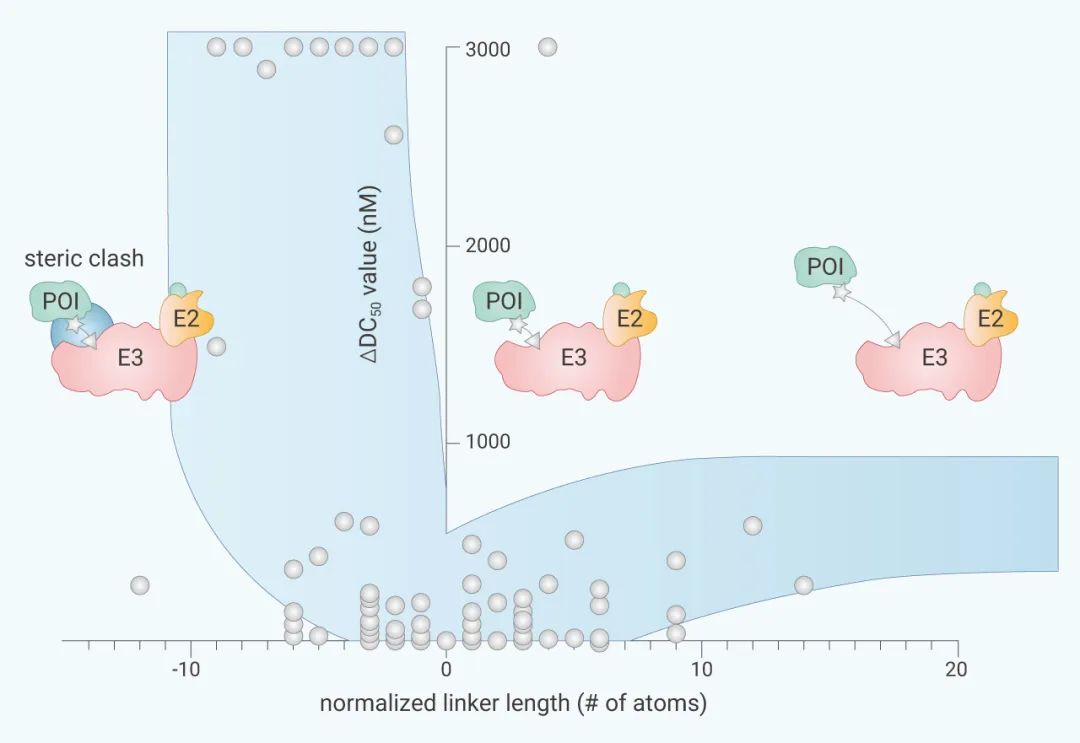
Linker 的设计目前没有成熟的方案,通过对目前报道和临床已知的 PROTAC 统计,大部分 Linker 所用原子的链长常在 10~20 个原子长度。另外也有研究通过归一化分析,总结了链长与降解活性的关系,从下图中大致可以看出:较长的链长由于更高的熵而使活性降低,但相较于较低链长导致的无法有效拉近配体两端分子距离这一结果,它的影响较小。所以分子设计初期一般会选择稍长的 Linker 链。
具体问题需要具体分析,Linker 的选择不但与蛋白结合域的深度相关,也会对配体与蛋白的结合以及整体 PROTAC 的物理性质造成影响。在 PROTAC 的后期优化中,它往往是考察的重点。
诚然,经过以上几步合理设计后虽然可以初步构建一个 PROTAC 分子,但它并不一定具有活性,任何药物的设计都不是一蹴而就,而是实验验证与总结设计螺旋上升的过程。在后期的结构优化分析原因时,仍然需要综合考量每一步设计中选择的分子、连接位点的合理性以及整体 PROTAC 的透膜性等问题。
MCE 拥有丰富的 PROTAC 成品分子,深得海内外众多科研用户的青睐。此外,我们还提供专业的 PROTAC 设计咨询服务,助力您高效合理药物设计。我们拥有经验丰富的合成技术团队,在最终 PROTAC 分子上为您提供快速、经济、高质量的合成服务。
| PROTAC |
是一种高效的,选择性的,细胞透过的基于 PROTAC 技术的 BET 降解剂,IC50 值为 14 nM,具有抗肿瘤活性。 |
是一种基于 PROTAC 技术的有效的 K-Ras 降解剂,在 SW1573 中对 K-Ras 降解率 ≥ 70%。 |
| SNIPER |
由 IAP 拮抗剂 LCL-161 衍生物和 BET 抑制剂 (+)-JQ-1,通过 linker 连接组成,诱导 BRD4 降解。SNIPER (BRD)-1 同时抑制 cIAP1,cIAP2 和 XIAP,IC50 分别为 6.8 nM,17 nM 和 49 nM。 |
由 Dasatinib (ABL 抑制剂) 通过 linker 与 Bestatin (cIAP1 配体) 组合而成,可有效降解 BCR-ABL 蛋白。 |
| Protac-linker conjugate for PAC |
PROTAC BRD4 Degrader-5-CO-PEG3-N3 是一种用于 PAC 的 PROTAC-linker 偶联物,包含 BRD4 降解剂 GNE-987 和 3 个 PEG 的 linker。 |
由 ADC linker 和 PROTAC 分子组成,PAC 与抗体偶联。与 PROTAC (不偶联 Ab) 相比,PAC 偶联抗体之后更加显著降低雌激素受体-α (ERα) 水平。 |
PROTAC BRD4 degrader for PAC-1 是一种用于 PAC 的 PROTAC-linker 偶联物,包含嵌合体 BET 降解剂 GNE-987 和含二硫化物的 linker。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
参考文献
1. Tao AJ, Gadbois GE, Buczynski SA, Ferguson FM. Targeted protein degradation: Emerging concepts and protein state-specific targeting principles. Curr Opin Chem Biol. 2022 Jan 15;67:102114.
8. Bemis TA, La Clair JJ, Burkart MD. Unraveling the Role of Linker Design in Proteolysis Targeting Chimeras. J Med Chem. 2021 Jun 24;64(12):8042-8052.