来宝网 2022/12/20点击409次
骨质疏松症是一种全身性代谢性骨病,其特征是骨髓间隙中的骨形成减少,导致骨量丢失和微观结构退变。据估计,骨质疏松症每年导致全球超过900万例骨折。因此,迫切需要替代骨质疏松症的治疗方法,特别是能够抵消骨量流失的疗法,这对于老年人群至关重要。
人骨髓来源的间充质干细胞(hMSCs)由于其多能性,是骨组织工程和再生医学的细胞疗法的理想选择。在机械或化学刺激下,可以诱导hMSCs分化为各种谱系,包括成骨细胞、神经母细胞、成脂肪细胞、成肌细胞和成软骨细胞。此外,hMSCs的分化受到局部机械和化学环境的密切控制,从而在成骨分化和脂肪分化之间保持平衡。成骨分化减少和脂肪分化增加可能导致骨质疏松症。研究已经鉴定出许多化学刺激(例如,小的生物活性分子,生长因子和遗传调节因子)来调节hMSCs谱系,包括骨形态发生蛋白(BMP),Wnt和Notch信号。
成骨分化是一个动态过程,涉及几种重要的信号通路,包括YAP / TAZ(具有PDZ结合基序的转录共激活因子),Notch和RhoA信号通路。研究表明,流体剪切力调节间充质干细胞(MSCs)的体外成骨分化。尽管目前的研究表明剪切应力可以增强成骨分化,但由于缺乏有效的工具来检测和监测活细胞中的基因表达,Notch信号在剪切应力诱导的成骨中的参与尚不清楚。
在美国纽黑文大学生物医学工程系、利哈伊大学生物工程系、杜克大学生物医学工程系、康涅狄格大学生物医学工程系的一项联合研究中,利用双链锁核酸/DNA(LNA/DNA)纳米生物传感器阐明了Notch信号在暴露于生理相关剪切应力(3-7 dynes/cm2)的hMSCs的成骨分化过程中的调节作用,研究结果将为剪切应力下hMSCs的成骨分化和Notch信号的参与提供新的信息。

流体剪切应力调节人骨髓来源的间充质干细胞的增殖和活力
为了研究不同水平的剪切应力对细胞增殖和活力的影响,设计并比较了3组实验:静态组,6 h剪切力刺激组和不间断剪切力刺激组。实验研究了两种不同水平的剪切应力:低流体剪切应力(1–9 dynes/cm2)和高流体剪切应力(9–20 dynes/cm2),分别在第3天和5天后评估细胞活力和增殖。
图1 A显示了不同组别下hMSCs在剪切应力下5 d后的荧光图像。当hMSCs暴露于连续剪切力5天时,死细胞的数量增加。实验进一步量化了剪切应力对细胞活力和增殖的影响。施用剪切3 d后,剪切应力下hMSCs的细胞活力和增殖与静态条件下的hMSCs相比没有显著差异(图1 B、C 左)。5 天后,连续剪切应力下的 hMSCs 细胞活力和增殖显著降低,与静态条件下的细胞相比,细胞活力降低 21.5%,增殖减少19.8%(图1 B、C 右)。此外,在每天6 h施加剪切应力5天后,hMSCs的细胞活力和增殖与静态状态的hMSCs相比没有显著差异。
此外,还研究了高流体剪切应力(9-20 dynes/cm2)对hMSCs的活力和增殖的影响。暴露于高剪切应力3天的hMSCs,不间断剪切应力组的细胞活力降低了55%。5 d后,6 h刺激组和不间断刺激组的死细胞数量均显著增加。此外,与静态的hMSCs相比,细胞活力分别降低了14.8%和19.2%。高流体剪切应力对细胞增殖的影响具有类似的影响。
这些结果表明,剪切应力调节细胞增殖和活力与时间和速度有关。在高流体剪切应力下,细胞活力和增殖降低。在低流体剪切应力下,当细胞暴露于周期性剪切(6h 剪切/天)而不是连续剪切(不间断剪切)时,其活力和增殖不受影响。总之,对于低流体剪切应力下的hMSCs,每天6小时,持续5天,与静态条件相比,细胞活力和增殖没有显著差异。因此,接下来的实验选择了3-7 dynes/cm2,以避免剪切应力对其余研究的细胞活力和增殖的影响。
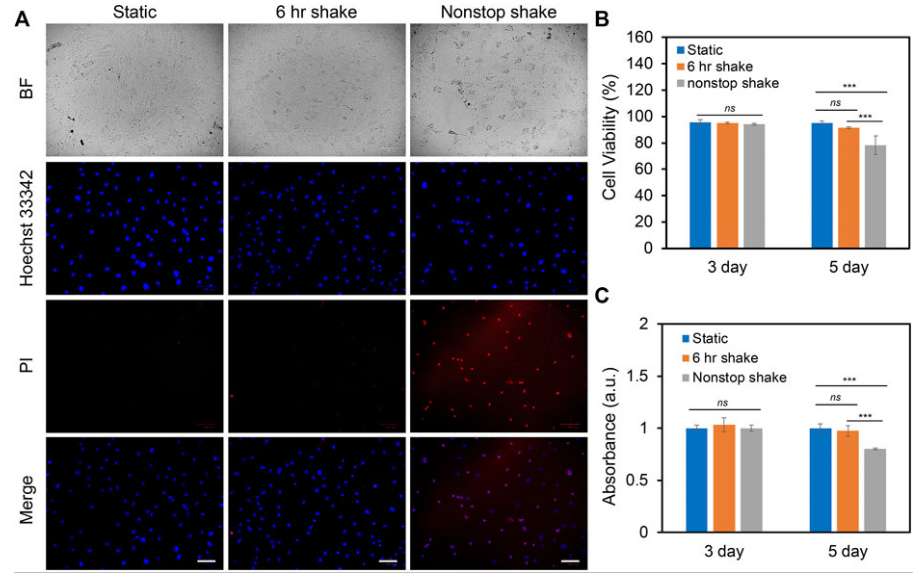
图1 剪切应力对细胞活力和增殖的影响。
低流体剪切应力调节人骨髓来源的间充质干细胞的形态
为了研究低流体剪切应力对hMSCs形态的影响,实验量化并比较了细胞表型行为,包括在有(3-7 dyne/cm2,6h)和没有剪切应力下的细胞面积,细胞长度,细胞长宽比以及细胞周长。
图2 A、B显示了hMSCs在静态条件下(图2 A)和暴露于剪切应力下(图2 B)的荧光图像。3天后,与静态条件下培养的hMSCs相比,在剪切应力下培养的hMSCs的细胞面积、长宽比、周长和细胞长度略有增加(细胞面积增加16.3%,细胞长宽比增加14.9%,周长增加18%,细胞长度增加12%)。然而,与在静态条件下培养的hMSCs相比,暴露于低流体剪切应力5天的hMSCs分别显示出细胞面积增加55%,细胞长度增加72%,细胞长宽比增加16%和细胞周长增加30%(图2 C、D)。这些结果表明,hMSCs对低流体剪切应力敏感,形态变化显著。
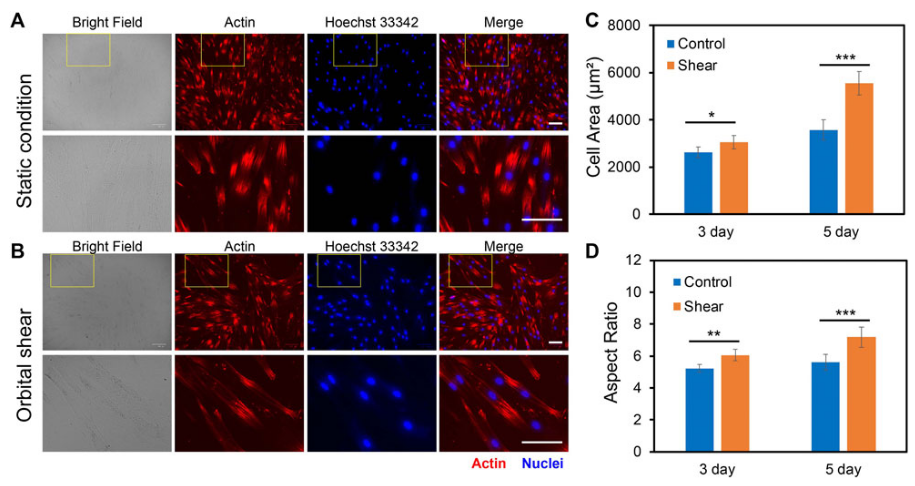
图2 剪切应力对hMSCs形态变化的影响。
低流体剪切应力促进成骨分化
通过施加剪切力(3-7 dyne/cm2),进一步阐明了低流体剪切应力对成骨分化的影响,在成骨诱导和剪切刺激5天后,通过测量ALP酶活性来评估和比较成骨分化,ALP酶活性是早期成骨分化的可靠生化标志物。
图3 A、B分别显示了静态和剪切应力下hMSCs的荧光图像。在剪切应力下,当诱导hMSCs进行成骨分化时,肌动蛋白细胞骨架发生显著改变。结果表明,在没有成骨诱导的情况下,绿色荧光信号最小,表明ALP酶活性最小。随着成骨诱导,在静态和剪切应力下,hMSCs的ALP酶活性显著提高。在静态条件下,在成骨诱导培养基中培养的hMSCs的ALP活性比在基础培养基中培养的hMSCs提高了1.8倍。在低流体剪切应力下,ALP活性提高了2.1倍。此外,与静态条件相比,暴露于剪切应力的hMSCs在成骨诱导后ALP活性增加了15%(图3 C)。此外,在低流体剪切应力下,hMSCs分化率提高到45.51%,而静态条件下hMSCs分化率为38.02%(图3 D)。这些结果表明,低流体剪切应力显著增强了成骨分化,ALP酶活性和成骨分化率增加。

图3 剪切应力增强hMSCs成骨分化。
Notch信号参与剪切应力诱导的成骨分化
先前的研究表明,Notch信号参与hMSCs成骨分化过程,介导的ALP活性以及成骨分化率。然而,低流体剪切应力是否通过Notch信号调节hMSCs的成骨分化尚不清楚。为了更好地了解Notch信号在成骨分化过程中的参与,利用药物DAPT(Notch信号抑制剂)来扰乱Notch信号传导。hMSCs在有或没有剪切应力下的成骨分化过程中用浓度为20 μM的DAPT处理,以观察潜在的相关影响。
图4 A、B显示了hMSCs在静态条件和剪切应力下在基础培养基,诱导培养基和加DAPT处理的诱导培养基中培养的代表性图像。结果表明,使用DAPT抑制Notch信号在静态条件和剪切应力下介导了成骨分化。特别是在静态条件下,随着DAPT的处理,成骨诱导5 d后的ALP酶活性降低了28.8%。同时,暴露于低流体剪切应力的hMSCs,诱导5 d后的ALP酶活性在DAPT处理下降低了18.2%。有趣的是,剪切应力下hMSCs的DAPT处理对成骨分化的影响较小,表明低流体剪切应力挽救了药物处理引起的Notch信号传导的抑制作用。
为了进一步研究在低流体剪切应力下成骨分化过程中Notch信号传导的机制,实验利用LNA/DNA纳米生物传感器在基础培养基,诱导培养基和DAPT处理的诱导培养基中检查了静态和剪切力条件下的Notch 1配体,Dll4 mRNA的表达。图4 A、B显示了不同处理下静态和剪应力下hMSCs的代表性图像。在静态条件下,用成骨诱导培养基培养的hMSCs显示出Dll4 mRNA的表达显著增加。DAPT处理后,与成骨诱导组相比,Dll4 mRNA显著降低(图4 D)。当暴露于低流体剪切应力时,成骨诱导组hMSCs的Dll4 mRNA表达比在基础培养基中培养的hMSCs增加了2.72倍。DAPT的处理抑制成骨分化约50%(图4 D)。与静态相比,在成骨诱导培养基中培养hMSCs时,Dll4 mRNA表达提高了22.8%。DAPT处理介导剪切应力对成骨分化的影响,Dll4 mRNA表达仅增加约16%。
这些结果证明,Notch信号参与并调节了低流体剪切应力下hMSCs的成骨分化。低流体剪切应力上调成骨诱导下hMSCs的Dll4 mRNA表达,表明Notch信号参与机械调节的成骨分化。Notch信号的抑制介导了剪切应力诱导的成骨分化的影响,ALP酶活性降低,Dll4 mRNA表达降低。

图4 Notch信号在有和无剪切应力情况下调节hMSCs的成骨分化。
在这项研究中,利用LNA/DNA纳米生物传感器在暴露于生理相关的低流体剪切应力的hMSCs的成骨分化过程中检测Dll4 mRNA基因表达谱。研究结果证明,Notch信号调节剪切应力诱导的成骨分化,表明Notch信号在成骨分化中的机械敏感性作用。进一步的研究可能阐明Notch信号在调节干细胞分化中的机械敏感作用的机制。
参考文献:Zhao Y, Richardson K, Yang R, Bousraou Z, Lee YK, Fasciano S, Wang S. Notch signaling and fluid shear stress in regulating osteogenic differentiation. Front Bioeng Biotechnol. 2022 Oct 5;10:1007430. doi: 10.3389/fbioe.2022.1007430. PMID: 36277376; PMCID: PMC9581166.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36277376/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用!




