来宝网 2023/8/31点击730次
CUT&Tag优于ChIP-Seq的关键竟是它?
前面几期,小翌介绍过“翌圣转座酶系列产品助力NGS文库构建”(戳链接了解详情)。本期,小翌重点聊聊pG-Tn5。
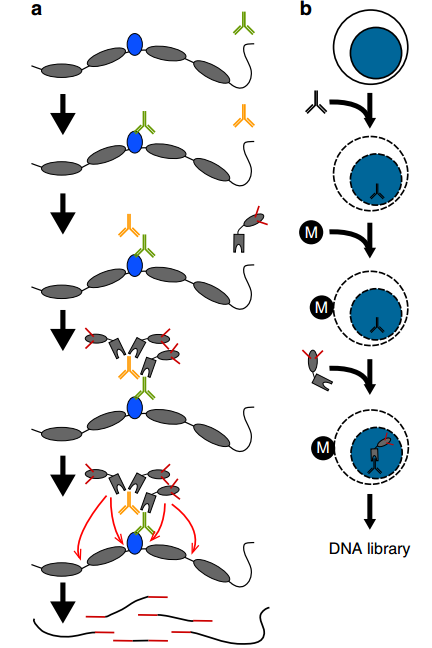
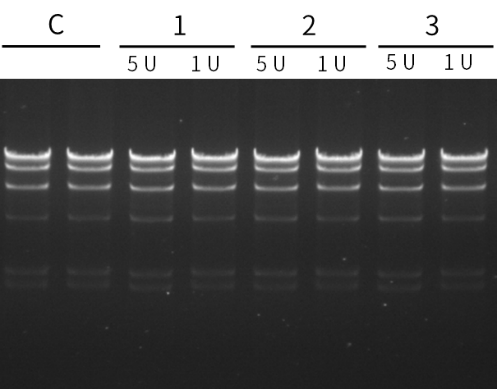
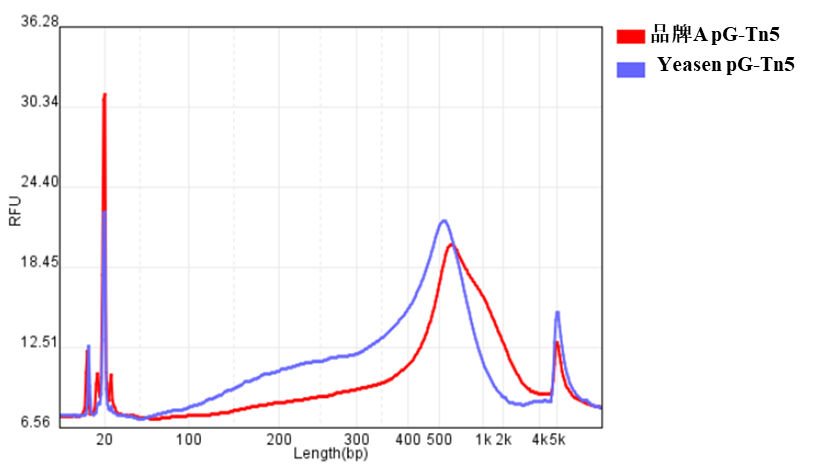
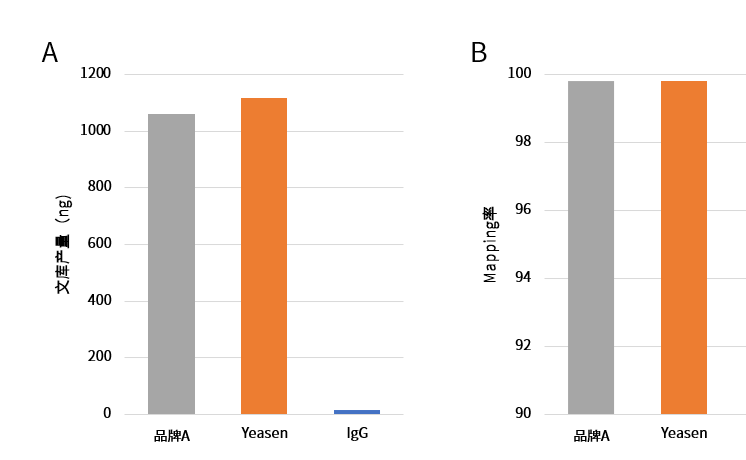
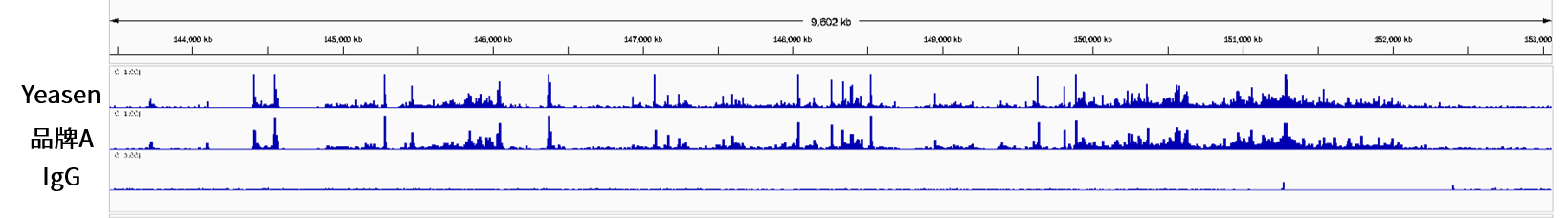
CUT&Tag(Cleavage Under Targets and Tagmentation)是一种新的DNA-蛋白质互作研究方法,该技术涉及的核心酶原料是pG-Tn5或pA-Tn5(pA-Tn5 Transposase)。Protein A(pA)与pG的作用类似,特异性结合抗体,从而使得pA-Tn5具备更高的靶向性。Protein A 和 Protein G与不同种类和免疫原性的抗体的亲和力具有较大区别[1],因此pA和pG可以靶向结合不同抗体。 图1. CUT &Tag技术原理图[2] 由于CUT&Tag主要是针对极低细胞起始量进行实验,这就要求核心酶原料具有高切割活性、对微量DNA有高灵敏度和高亲和力以及超低污染性。翌圣ZymeEditor™酶改造平台将改造的具有超高活性的Tn5转座酶突变体与Protein G融合,从而获得能精准、高效切割目的蛋白附近DNA序列的pG-Tn5(Cat#14530ES)。翌圣pG-Tn5具有核酸酶残留低、片段化能力强(切割活性)、建库产量高等优势,可用于CUT&Tag实验。 无核酸外切酶残留 将1 U/5 U的pG-Tn5 Transposase分别与底物DNA在37°C下孵育4 h,琼脂糖凝胶电泳比较DNA谱带变化,结果显示翌圣pG-Tn5 Transposase在5 U投入量下未检出核酸外切酶残留。 图2. pG-Tn5 Transposase核酸外切酶残留检测 相同酶投入量下,片段化能力优于其它品牌 分别使用翌圣及品牌A相同酶量的pG-Tn5 Transposase对200 ng gDNA进行片段化,Agilent 2100检测片段大小分布,结果显示:相同酶量下,翌圣pG-Tn5 Transposase片段化效果更好,酶活性更高。 图3. pG-Tn5 Transposase片段化能力检测 分别使用翌圣及品牌A相同酶量的pG-Tn5 Transposase对1000个细胞投入量样本建库,并对文库测序后的数据进行分析,结果显示翌圣pG-Tn5 Transposase文库产量高于品牌A(图4A),Mapping率相当(图4B); 染色质上的信号分布情况与品牌A一致(图5)。 图4. pG-Tn5 Transposase应用于CUT&Tag的文库产量及Mapping率 图5. pG-Tn5 Transposase应用于CUT&Tag在染色质上的信号分布 应用 定位 产品名称 产品货号 转座酶建库ATAC建库 Tn5单酶 Tn5 Transposase 14524ES 建库试剂盒 Hieff NGS® Fast Tagment DNA Library Prep Kit for Illumina®(for 50 ng) 12207ES CUT&Tag建库 pA-Tn5单酶 pA-Tn5 Transposase 14528ES pG-Tn5单酶 pG-Tn5 Transposase 14530ES 建库试剂盒 Hieff NGS® G-Type In-Situ DNA Binding Profiling Library Prep Kit for Illumina 12598ES 参考文献 [1] Dancette OP, Taboureau JL, Tournier E, et al. Purification of immunoglobulins G by protein A/G affinity membrane chromatography. J Chromatogr B Biomed Sci Appl. 1999 Feb 19;723(1-2):61-8. doi: 10.1016/s0378-4347(98)00470-8. [2] Kaya-Okur HS, Wu SJ, Codomo CA, et al. CUT&Tag for efficient epigenomic profiling of small samples and single cells. Nat Commun. 2019 Apr 29;10(1):1930. doi: 10.1038/s41467-019-09982-5.
与传统的ChIP-Seq相比,CUT&Tag不需要使用甲醛交联以及免疫共沉淀,而是通过针对靶蛋白(如转录因子、染色质重塑蛋白)的抗体和Protein G/A的介导,使得与Protein G/A融合的Tn5酶在切割DNA片段的同时在序列两端加上测序接头,经PCR扩增后即可形成用于高通量测序的文库(图1)。CUT &Tag技术具有细胞投入量低、信噪比高、实验周期短(1天实现文库构建)、可重复性好等显著优势,可应用于蛋白质与DNA互作研究、检测组蛋白修饰在基因组上分布位点、鉴定转录因子在全基因组上的结合位点、超级增强子鉴定等。